دوره 22، شماره 6 - ( بهمن و اسفند 1398 )
جلد 22 شماره 6 صفحات 229-218 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghane M, Adham F. Frequency of TEM and PER Beta-Lactamase Genes in Urinary Isolates of Escherichia Coli Producing Extended-Spectrum Beta-Lactamases. J Arak Uni Med Sci 2020; 22 (6) :218-229
URL: http://jams.arakmu.ac.ir/article-1-6064-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6064-fa.html
قانع مریم، ادهم فریبا. فراوانی ژنهای بتالاکتاماز TEM و PER در ایزولههای ادراری اشرشیاکلی مولد بتالاکتامازهای
وسیعالطیف در شهرستان کرج. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (6) :218-229
مریم قانع 

 1، فریبا ادهم2
1، فریبا ادهم2 




 1، فریبا ادهم2
1، فریبا ادهم2 


1- گروه زیست شناسی، واحد اسلامشهر، دانشگاه آزاد اسلامی واحد اسلامشهر، اسلامشهر ایران. ، ghane@iiau.ac.ir
2- گروه زیست شناسی، واحد اسلامشهر، دانشگاه آزاد اسلامی واحد اسلامشهر، اسلامشهر ایران.
2- گروه زیست شناسی، واحد اسلامشهر، دانشگاه آزاد اسلامی واحد اسلامشهر، اسلامشهر ایران.
متن کامل [PDF 2530 kb]
(983 دریافت)
| چکیده (HTML) (2322 مشاهده)
متن کامل: (1651 مشاهده)
مقدمه
عفونتهای دستگاه ادراری یکی از مهمترین بیماریهای عفونی در جامعه و نیز در بیمارستانهاست و باعث افزایش مرگومیر میشود. میکروارگانیسمهای مختلفی مسئول ایجاد عفونتهای ادراری هستند که در بین آنها باکتریها مهمترین عوامل ایجادکننده بوده و در بین باکتریها، اشرشیاکلی شایعترین ارگانیسم است و بیش از 80 درصد عفونتها را شامل میشود [1]. تشخیص بیش از 150 میلیون مورد عفونت ادراری در هر سال در سراسر جهان، باعث شده که از زمانهای گذشته از آن به عنوان یکی از متداولترین عفونتهای کسبشده از جامعه و نیز بیمارستان یاد شود [2].
مصرف بیش از حد و سوءمصرف آنتیبیوتیکها در درمان عفونتهای ادراری باعث فشار انتخابی آنتیبیوتیک شده که نتیجه آن افزایش و پراکندهشدن باکتریهای مقاوم در برابر چند داروست. در حال حاضر، کاهش حساسیت به بسیاری از آنتیبیوتیکها در ایزولههای ادراری اشرشیاکلی مشاهده میشود. این وضعیت به طور معمول در بیمارستانها مشاهده میشود و میتواند به افزایش هزینه بیمارستان، اقامت طولانیمدت در بیمارستان و همچنین شکست درمان منجر شود [3].
در میان آنتیبیوتیکها، بتالاکتامها به دلیل عدم سمّیت به عنوان یکی از پرمصرفترین داروهای شیمیدرمانی محسوب میشوند. این ترکیبات در طی 60 سال گذشته، در بین مؤثرترین داروها در درمان عفونتهای باکتریایی ناشی از گونههای متعدد باکتریها بودهاند و از سال 2004 بیش از 65 درصد از بازار جهانی آنتیبیوتیک را به خود اختصاص دادهاند [4].
تولید آنزیمهای بتالاکتاماز توسط میکروارگانیسمهای گرم مثبت و گرم منفی مهمترین مکانیسم مقاومت در برابر آنتیبیوتیکهای بتالاکتام است. بتالاکتامازهای وسیعالطیف آنزیمهایی هستند که باعث ایجاد مقاومت به سفالوسپورینهای وسیعالطیف میشوند. از آنجایی که این آنزیمها توسط پلاسمید رمز میشوند، مقاومت باکتریایی به دلیل این آنزیمها بهسرعت منتشر میشود. این پلاسمیدها اغلب ژنهای مقاومت در برابر سایر آنتیبیوتیکها مانند آمینوگلیکوزیدها، فلوروکینولون ها، تتراسایکلین، کلرامفنیکل و تری متوپریم سولفامتوکسازول را نیز با خود حمل میکنند [5].
در باکتریها مکانیسم اصلی مقاومت نسبت به بتالاکتامها بیان بتالاکتامازهای TEM است. بتالاکتاماز TEM اولینبار در یک بیمار مبتلا به عفونت ادراری به نام تمورینا شناسایی شد. بتالاکتامازهای TEM یکی از مهمترین بتالاکتامازهای پلاسمیدی در باکتریهای خانواده انتروباکتریاسه و از علل مهم بروز مقاومتهای چنددارویی در عفونتهای بیمارستانی هستند. بتالاکتامازهای وسیعالطیف وابسته به TEM، اغلب از بتالاکتامازهای اصلی (TEM-1, TEM-2) با جایگزینی یک یا دو اسید آمینه در جایگاه فعال آنزیم حاصل شدهاند [6].
آنزیمهای PER نوع دیگری از بتالاکتامازهای وسیعالطیف هستند. این آنزیمها برای اولینبار در سودوموناس آئروژینوزا شناسایی شدند، اما در سایر ارگانیسمها، بهویژه در ایزولههای اسینتوباکتر نیز شناسایی شدهاند [7].
درمان عفونتهای ادراری اغلب به طور تجربی و بر اساس گزارشات موجود در زمینه الگوی مقاومت آنتیبیوتیکی پاتوژنهای ادراری آغاز میشود. ارائه مداوم الگوهای مقاومت آنتیبیوتیکی در هر منطقه میتواند علاوه بر درمان عفونتهای ادراری، از انتشار سویههای مقاوم جلوگیری کند. بنابراین، هدف از این مطالعه، تعیین میزان شیوع باکتریهای اشرشیاکلی تولیدکننده بتالاکتامازهای وسیعالطیف جداشده از ادرار بیماران مبتلا به عفونت ادراری، تعیین حساسیت آنها به آنتیبیوتیکهای رایج مورد استفاده در عفونت ادراری و بررسی میزان شیوع بتالاکتامازهای نوع TEM و PER بود.
مواد و روشها
کشت نمونه و شناسایی باکتریها
این مطالعه مقطعی توصیفی در یک بازه زمانی 13ماهه (از بهمن 1394 تا دی) بر روی 972 نمونه مشکوک به عفونت ادراری با علائم سوزش و تکرر ادرار از بیماران سرپایی مراجعهکننده به بیمارستانهای امام خمینی، قائم و شهید رجایی شهرستان کرج و نیز آزمایشگاههای این شهرستان صورت گرفت. نمونههای ادراری از قسمت میانی جریان ادرار بیماران مشکوک به عفونت ادراری در لولههای استریل جمعآوری شدند. از نمونههای ادراری بر روی محیط بلاد آگار، ائوزین متیلن بلو آگار (مرک، آلمان) تلقیح شدند. بعد از گرماگذاری در 37 درجه سلسیوس به مدت 24 ساعت، پلیتهایی که رشد قابل ملاحظه داشتند (CFU 105) برای آزمایشات بعدی انتخاب شدند و از آنها کشت خالص تهیه شد. شناسایی باکتریها با استفاده از مورفولوژی، رنگآمیزی گرم و خواص بیوشیمیایی آنها انجام شد [8]. آزمونهای بیوشیمیایی مورد استفاده شامل کاتالاز، اکسیداز، کشت بر روی محیط SIM، محیط متیل رد، وژس پروس کوئر، TSI و مصرف سیترات بودند. از 972 نمونه ادراری مشکوک به عفونت ادراری 500 سویه اشرشیاکلی شناسایی شد.
غربالگری سویههای تولیدکننده بتالاکتامازهای وسیعالطیف و بررسی حساسیت آنتیبیوتیکی
غربالگری سویههای اشرشیاکلی تولیدکننده بتالاکتامازهای وسیعالطیف با استفاده از روش دیسکهای ترکیبی و با استفاده از دو جفت دیسک سفوتاکسیم (µg 30) و سفوتاکسیم / کلاوولانیک اسید (10µg/30)، سفتازیدیم (µg 30) و سفتازیدیم / کلاوولانیک اسید (10µg/30) (شرکت روسکو، دانمارک) و مطابق با توصیههای مؤسسه استاندارد روشهای آزمایشگاهی انجام شد [9]. برای این منظور چند کلنی از کشت شبانه باکتریها در محیط نوترینت آگار برداشته و در سرم فیزیولوژی استریل سوسپانسیونی معادل نیم مک فارلند تهیه شد و با استفاده از سواپ استریل بر روی پلیت حاوی محیط کشت مولر هینتون آگار (مرک، آلمان) به صورت متراکم کشت داده شد.
پس از قراردادن دیسکها بر روی پلیت و گرماگذاری به مدت 24 ساعت در 37 درجه سلسیوس، مسافت انتشار اطراف هر دیسک با استفاده از خطکش میلیمتری اندازهگیری و نتایج با استفاده از جداول استاندارد CLSI تفسیر شدند. اختلاف mm 5 ≤ بین قطر هاله عدم رشد اطراف سفوتاکسیم و سفوتاکسیم / کلاوولانیک اسید و نیز سفتازیدیم و سفتازیدیم / کلاوولانیک اسید به عنوان فنوتیپ مثبت در نظر گرفته شد. برای کنترل کیفی نتایج ESBL، از سویه استاندارد کلبسیلا پنومونیه ATCC700603 استفاده شد.
سنجش حساسیت آنتیبیوتیکی سویههای مولد بتالاکتامازهای وسیعالطیف با استفاده از آنتیبیوتیکهای جنتامیسین (μg 10)، تتراسایکلین (µg 30)، تری متوپریم سولفامتوکسازول (µg 25)، ایمیپنم (μg 10)، آمیکاسین (µg 30) و سیپروفلوکساسین (µg 5) (شرکت روسکو، دانمارک) انجام شد. برای کنترل کیفی آنتیبیوگرام از سویه اشرشیاکلی ATCC25922 استفاده شد برای این منظور سوسپانسیونی معادل نیم مک فارلند از سویه مذکور تهیه شد و با استفاده از سواپ استریل بر روی محیط کشت مولر هینتون آگار به صورت متراکم کشت داده شد و دیسکها با فاصله 22 میلیمتر از یکدیگر بر روی پلیت قرار داده شد. کنترل کیفی دیسکها به صورت روزانه انجام گرفت.
شناسایی مولکولی ژنهای blaTEM و blaPER
برای تهیه DNA ژنومی، تکههایی از چند کلنی از هریک از سویههای جداشده در پنج میلیلیتر محیط کشت لوریا برتانی (LB) (مرک، آلمان) در دمای 37 درجه سلسیوس به صورت شبانه کشت داده شد. سپس استخراج DNA با استفاده از کیت استخراج DNA (سیناکلون، ایران) و بر اساس دستور کار شرکت سازنده کیت صورت گرفت.
کمیت و کیفیت DNA با استفاده از دستگاه نانودراپ مدل 2000 (آمریکا) در طول موجهای 260 نانومتر و 280 نانومتر تعیین شد. آزمایش PCR برای شناسایی ژن blaTEM و blaPER با استفاده از پرایمرهای اختصاصی انجام گرفت. توالی پرایمرهای مورد استفاده و طول قطعات حاصل از PCR در جدول شماره 1 نشان داده شده است. واکنش PCR با استفاده از 10 میکرولیتر مستر میکس (سیناژن، ایران)، 1 میکرولیتر از هریک از پرایمرها (50 پیکومول)، 2 میکرولیتر (50 پیکومول) DNA و آب مقطر دیونیزه استریل تا حجم 20 میکرولیتر انجام شد.
برنامه زمانی PCR با یک سیکل 94 درجه سلسیوس به مدت پنج دقیقه برای واسرشتسازی اولیه آغاز شد. سپس با 30 سیکل شامل واسرشتسازی در دمای 94 درجه سلسیوس به مدت 30 ثانیه، اتصال پرایمرها در دمای 55 درجه سلسیوس به مدت 30 ثانیه و طویلسازی در دمای 72 درجه سلسیوس به مدت یک دقیقه و 30 ثانیه ادامه یافت. درنهایت 1 سیکل 72 درجه سلسیوس به مدت پنج دقیقه برای طویلسازی نهایی انجام گرفت. واکنش PCR در دستگاه ترمال سایکلر (PEQ STAR، آلمان) انجام شد، سپس محصولات PCR بر روی ژل آگارز 5/1 درصد (مرک، آلمان) الکتروفورز شدند.
از سویههای کلبسیلا پنومونیه ATCC700603 و سودوموناس آئروژینوزا سویه KOAS به ترتیب به عنوان کنترل مثبت برای ژنهای TEM و PER استفاده شد [10، 11].
تجزیه و تحلیل آماری
تجزیه و تحلیل دادهها با استفاده از نرمافزار SPSS نسخه 20 و با استفاده از آزمون مربع کای انجام شد و P≤0/05 معنیدار در نظر گرفته شد.
یافتهها
درمجموع، از 972 نمونه مشکوک به عفونت ادراری، 780 نمونه عفونی تشخیص داده شد و از بین آنها 500 ایزوله اشرشیاکلی جداسازی شد. میانگین سنی افراد مبتلا 16±45 سال بود. در این بین 169 نمونه (33/8 درصد) مربوط به مردان و 331 نمونه (66/26 درصد) مربوط به زنان بود. از بین 500 ایزوله اشرشیاکلی، 180 ایزوله (36 درصد) از لحاظ تولید بتالاکتاماز، مثبت بودند. تعداد سویههای ESBL در زنان (132 نمونه؛ 73/33 درصد) بیش از مردان (8 نمونه؛ 26/76 درصد) بود (0/007=P).
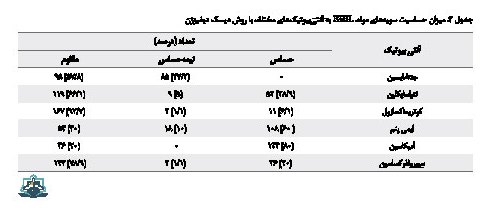
حساسیت آنتیبیوتیکی سویههای مولد ESBL در جدول شماره 2 نشان داده شده است. همانطور که در جدول مشاهده میشود سویههای تولیدکننده بتالاکتامازهای وسیعالطیف نسبت به کوتریموکسازول و سیپروفلوکساسین مقاومت بالایی نشان دادند.
عفونتهای دستگاه ادراری یکی از مهمترین بیماریهای عفونی در جامعه و نیز در بیمارستانهاست و باعث افزایش مرگومیر میشود. میکروارگانیسمهای مختلفی مسئول ایجاد عفونتهای ادراری هستند که در بین آنها باکتریها مهمترین عوامل ایجادکننده بوده و در بین باکتریها، اشرشیاکلی شایعترین ارگانیسم است و بیش از 80 درصد عفونتها را شامل میشود [1]. تشخیص بیش از 150 میلیون مورد عفونت ادراری در هر سال در سراسر جهان، باعث شده که از زمانهای گذشته از آن به عنوان یکی از متداولترین عفونتهای کسبشده از جامعه و نیز بیمارستان یاد شود [2].
مصرف بیش از حد و سوءمصرف آنتیبیوتیکها در درمان عفونتهای ادراری باعث فشار انتخابی آنتیبیوتیک شده که نتیجه آن افزایش و پراکندهشدن باکتریهای مقاوم در برابر چند داروست. در حال حاضر، کاهش حساسیت به بسیاری از آنتیبیوتیکها در ایزولههای ادراری اشرشیاکلی مشاهده میشود. این وضعیت به طور معمول در بیمارستانها مشاهده میشود و میتواند به افزایش هزینه بیمارستان، اقامت طولانیمدت در بیمارستان و همچنین شکست درمان منجر شود [3].
در میان آنتیبیوتیکها، بتالاکتامها به دلیل عدم سمّیت به عنوان یکی از پرمصرفترین داروهای شیمیدرمانی محسوب میشوند. این ترکیبات در طی 60 سال گذشته، در بین مؤثرترین داروها در درمان عفونتهای باکتریایی ناشی از گونههای متعدد باکتریها بودهاند و از سال 2004 بیش از 65 درصد از بازار جهانی آنتیبیوتیک را به خود اختصاص دادهاند [4].
تولید آنزیمهای بتالاکتاماز توسط میکروارگانیسمهای گرم مثبت و گرم منفی مهمترین مکانیسم مقاومت در برابر آنتیبیوتیکهای بتالاکتام است. بتالاکتامازهای وسیعالطیف آنزیمهایی هستند که باعث ایجاد مقاومت به سفالوسپورینهای وسیعالطیف میشوند. از آنجایی که این آنزیمها توسط پلاسمید رمز میشوند، مقاومت باکتریایی به دلیل این آنزیمها بهسرعت منتشر میشود. این پلاسمیدها اغلب ژنهای مقاومت در برابر سایر آنتیبیوتیکها مانند آمینوگلیکوزیدها، فلوروکینولون ها، تتراسایکلین، کلرامفنیکل و تری متوپریم سولفامتوکسازول را نیز با خود حمل میکنند [5].
در باکتریها مکانیسم اصلی مقاومت نسبت به بتالاکتامها بیان بتالاکتامازهای TEM است. بتالاکتاماز TEM اولینبار در یک بیمار مبتلا به عفونت ادراری به نام تمورینا شناسایی شد. بتالاکتامازهای TEM یکی از مهمترین بتالاکتامازهای پلاسمیدی در باکتریهای خانواده انتروباکتریاسه و از علل مهم بروز مقاومتهای چنددارویی در عفونتهای بیمارستانی هستند. بتالاکتامازهای وسیعالطیف وابسته به TEM، اغلب از بتالاکتامازهای اصلی (TEM-1, TEM-2) با جایگزینی یک یا دو اسید آمینه در جایگاه فعال آنزیم حاصل شدهاند [6].
آنزیمهای PER نوع دیگری از بتالاکتامازهای وسیعالطیف هستند. این آنزیمها برای اولینبار در سودوموناس آئروژینوزا شناسایی شدند، اما در سایر ارگانیسمها، بهویژه در ایزولههای اسینتوباکتر نیز شناسایی شدهاند [7].
درمان عفونتهای ادراری اغلب به طور تجربی و بر اساس گزارشات موجود در زمینه الگوی مقاومت آنتیبیوتیکی پاتوژنهای ادراری آغاز میشود. ارائه مداوم الگوهای مقاومت آنتیبیوتیکی در هر منطقه میتواند علاوه بر درمان عفونتهای ادراری، از انتشار سویههای مقاوم جلوگیری کند. بنابراین، هدف از این مطالعه، تعیین میزان شیوع باکتریهای اشرشیاکلی تولیدکننده بتالاکتامازهای وسیعالطیف جداشده از ادرار بیماران مبتلا به عفونت ادراری، تعیین حساسیت آنها به آنتیبیوتیکهای رایج مورد استفاده در عفونت ادراری و بررسی میزان شیوع بتالاکتامازهای نوع TEM و PER بود.
مواد و روشها
کشت نمونه و شناسایی باکتریها
این مطالعه مقطعی توصیفی در یک بازه زمانی 13ماهه (از بهمن 1394 تا دی) بر روی 972 نمونه مشکوک به عفونت ادراری با علائم سوزش و تکرر ادرار از بیماران سرپایی مراجعهکننده به بیمارستانهای امام خمینی، قائم و شهید رجایی شهرستان کرج و نیز آزمایشگاههای این شهرستان صورت گرفت. نمونههای ادراری از قسمت میانی جریان ادرار بیماران مشکوک به عفونت ادراری در لولههای استریل جمعآوری شدند. از نمونههای ادراری بر روی محیط بلاد آگار، ائوزین متیلن بلو آگار (مرک، آلمان) تلقیح شدند. بعد از گرماگذاری در 37 درجه سلسیوس به مدت 24 ساعت، پلیتهایی که رشد قابل ملاحظه داشتند (CFU 105) برای آزمایشات بعدی انتخاب شدند و از آنها کشت خالص تهیه شد. شناسایی باکتریها با استفاده از مورفولوژی، رنگآمیزی گرم و خواص بیوشیمیایی آنها انجام شد [8]. آزمونهای بیوشیمیایی مورد استفاده شامل کاتالاز، اکسیداز، کشت بر روی محیط SIM، محیط متیل رد، وژس پروس کوئر، TSI و مصرف سیترات بودند. از 972 نمونه ادراری مشکوک به عفونت ادراری 500 سویه اشرشیاکلی شناسایی شد.
غربالگری سویههای تولیدکننده بتالاکتامازهای وسیعالطیف و بررسی حساسیت آنتیبیوتیکی
غربالگری سویههای اشرشیاکلی تولیدکننده بتالاکتامازهای وسیعالطیف با استفاده از روش دیسکهای ترکیبی و با استفاده از دو جفت دیسک سفوتاکسیم (µg 30) و سفوتاکسیم / کلاوولانیک اسید (10µg/30)، سفتازیدیم (µg 30) و سفتازیدیم / کلاوولانیک اسید (10µg/30) (شرکت روسکو، دانمارک) و مطابق با توصیههای مؤسسه استاندارد روشهای آزمایشگاهی انجام شد [9]. برای این منظور چند کلنی از کشت شبانه باکتریها در محیط نوترینت آگار برداشته و در سرم فیزیولوژی استریل سوسپانسیونی معادل نیم مک فارلند تهیه شد و با استفاده از سواپ استریل بر روی پلیت حاوی محیط کشت مولر هینتون آگار (مرک، آلمان) به صورت متراکم کشت داده شد.
پس از قراردادن دیسکها بر روی پلیت و گرماگذاری به مدت 24 ساعت در 37 درجه سلسیوس، مسافت انتشار اطراف هر دیسک با استفاده از خطکش میلیمتری اندازهگیری و نتایج با استفاده از جداول استاندارد CLSI تفسیر شدند. اختلاف mm 5 ≤ بین قطر هاله عدم رشد اطراف سفوتاکسیم و سفوتاکسیم / کلاوولانیک اسید و نیز سفتازیدیم و سفتازیدیم / کلاوولانیک اسید به عنوان فنوتیپ مثبت در نظر گرفته شد. برای کنترل کیفی نتایج ESBL، از سویه استاندارد کلبسیلا پنومونیه ATCC700603 استفاده شد.
سنجش حساسیت آنتیبیوتیکی سویههای مولد بتالاکتامازهای وسیعالطیف با استفاده از آنتیبیوتیکهای جنتامیسین (μg 10)، تتراسایکلین (µg 30)، تری متوپریم سولفامتوکسازول (µg 25)، ایمیپنم (μg 10)، آمیکاسین (µg 30) و سیپروفلوکساسین (µg 5) (شرکت روسکو، دانمارک) انجام شد. برای کنترل کیفی آنتیبیوگرام از سویه اشرشیاکلی ATCC25922 استفاده شد برای این منظور سوسپانسیونی معادل نیم مک فارلند از سویه مذکور تهیه شد و با استفاده از سواپ استریل بر روی محیط کشت مولر هینتون آگار به صورت متراکم کشت داده شد و دیسکها با فاصله 22 میلیمتر از یکدیگر بر روی پلیت قرار داده شد. کنترل کیفی دیسکها به صورت روزانه انجام گرفت.
شناسایی مولکولی ژنهای blaTEM و blaPER
برای تهیه DNA ژنومی، تکههایی از چند کلنی از هریک از سویههای جداشده در پنج میلیلیتر محیط کشت لوریا برتانی (LB) (مرک، آلمان) در دمای 37 درجه سلسیوس به صورت شبانه کشت داده شد. سپس استخراج DNA با استفاده از کیت استخراج DNA (سیناکلون، ایران) و بر اساس دستور کار شرکت سازنده کیت صورت گرفت.
کمیت و کیفیت DNA با استفاده از دستگاه نانودراپ مدل 2000 (آمریکا) در طول موجهای 260 نانومتر و 280 نانومتر تعیین شد. آزمایش PCR برای شناسایی ژن blaTEM و blaPER با استفاده از پرایمرهای اختصاصی انجام گرفت. توالی پرایمرهای مورد استفاده و طول قطعات حاصل از PCR در جدول شماره 1 نشان داده شده است. واکنش PCR با استفاده از 10 میکرولیتر مستر میکس (سیناژن، ایران)، 1 میکرولیتر از هریک از پرایمرها (50 پیکومول)، 2 میکرولیتر (50 پیکومول) DNA و آب مقطر دیونیزه استریل تا حجم 20 میکرولیتر انجام شد.
برنامه زمانی PCR با یک سیکل 94 درجه سلسیوس به مدت پنج دقیقه برای واسرشتسازی اولیه آغاز شد. سپس با 30 سیکل شامل واسرشتسازی در دمای 94 درجه سلسیوس به مدت 30 ثانیه، اتصال پرایمرها در دمای 55 درجه سلسیوس به مدت 30 ثانیه و طویلسازی در دمای 72 درجه سلسیوس به مدت یک دقیقه و 30 ثانیه ادامه یافت. درنهایت 1 سیکل 72 درجه سلسیوس به مدت پنج دقیقه برای طویلسازی نهایی انجام گرفت. واکنش PCR در دستگاه ترمال سایکلر (PEQ STAR، آلمان) انجام شد، سپس محصولات PCR بر روی ژل آگارز 5/1 درصد (مرک، آلمان) الکتروفورز شدند.
از سویههای کلبسیلا پنومونیه ATCC700603 و سودوموناس آئروژینوزا سویه KOAS به ترتیب به عنوان کنترل مثبت برای ژنهای TEM و PER استفاده شد [10، 11].
تجزیه و تحلیل آماری
تجزیه و تحلیل دادهها با استفاده از نرمافزار SPSS نسخه 20 و با استفاده از آزمون مربع کای انجام شد و P≤0/05 معنیدار در نظر گرفته شد.
یافتهها
درمجموع، از 972 نمونه مشکوک به عفونت ادراری، 780 نمونه عفونی تشخیص داده شد و از بین آنها 500 ایزوله اشرشیاکلی جداسازی شد. میانگین سنی افراد مبتلا 16±45 سال بود. در این بین 169 نمونه (33/8 درصد) مربوط به مردان و 331 نمونه (66/26 درصد) مربوط به زنان بود. از بین 500 ایزوله اشرشیاکلی، 180 ایزوله (36 درصد) از لحاظ تولید بتالاکتاماز، مثبت بودند. تعداد سویههای ESBL در زنان (132 نمونه؛ 73/33 درصد) بیش از مردان (8 نمونه؛ 26/76 درصد) بود (0/007=P).
حساسیت آنتیبیوتیکی سویههای مولد ESBL در جدول شماره 2 نشان داده شده است. همانطور که در جدول مشاهده میشود سویههای تولیدکننده بتالاکتامازهای وسیعالطیف نسبت به کوتریموکسازول و سیپروفلوکساسین مقاومت بالایی نشان دادند.
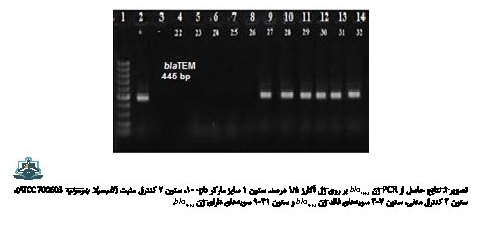
نتایج حاصل از بررسی ژنهای بتالاکتاماز TEM با استفاده از پرایمرهای اختصاصی در تصویر شماره 1 نشان داده شده است. نتایج نشان داد که ژن blaTEM در 85 ایزوله (44/72 درصد) مولد ESBL وجود دارد، در حالی که ژنهای blaRER در هیچیک از ایزولهها مشاهده نشد.
بحث
در طی دهههای گذشته، باسیلهای گرم منفی تولیدکننده بتالاکتامازهای وسیعالطیف به عنوان پاتوژنهای مهم در عفونتهای بیمارستانی و نیز عفونتهای کسبشده از جامعه در سرتاسر جهان پدیدار شدهاند. آگاهی از مقاومت آنتیبیوتیکی این سویهها و میزان شیوع آنها در هر منطقه میتواند به کنترل این میکروارگانیسمها کمک کرده و از انتشار این پاتوژنها جلوگیری کند. این مطالعه بر روی 972 نمونه ادراری مشکوک به عفونت ادراری که به بیمارستانها و آزمایشگاههای شهرستان کرج ارجاع داده شده بود، صورت گرفت. از بین نمونههای مورد آزمایش، 780 نمونه عفونی تشخیص داده شد و باکتری اشرشیاکلی از 500 نمونه (64/1 درصد) جداسازی شد.
در مطالعات انجامشده توسط جبرالدینی و همکاران باکتری اشرشیاکلی از 7/43 درصد نمونههای عفونی ادرار جدا شد [12]. در مطالعه محمدی و همکاران در سنندج نیز اشریشیاکلی بـا 63/9 درصـد، شـایعتـرین بـــاکتری جـــداشـــده از بیمـــاران مبتلا به عفونت ادراری بود [13]. نتایج مشابهی در مطالعات انجامشده در سایر کشورها به دست آمد [14، 15].
در طی دهههای گذشته، باسیلهای گرم منفی تولیدکننده بتالاکتامازهای وسیعالطیف به عنوان پاتوژنهای مهم در عفونتهای بیمارستانی و نیز عفونتهای کسبشده از جامعه در سرتاسر جهان پدیدار شدهاند. آگاهی از مقاومت آنتیبیوتیکی این سویهها و میزان شیوع آنها در هر منطقه میتواند به کنترل این میکروارگانیسمها کمک کرده و از انتشار این پاتوژنها جلوگیری کند. این مطالعه بر روی 972 نمونه ادراری مشکوک به عفونت ادراری که به بیمارستانها و آزمایشگاههای شهرستان کرج ارجاع داده شده بود، صورت گرفت. از بین نمونههای مورد آزمایش، 780 نمونه عفونی تشخیص داده شد و باکتری اشرشیاکلی از 500 نمونه (64/1 درصد) جداسازی شد.
در مطالعات انجامشده توسط جبرالدینی و همکاران باکتری اشرشیاکلی از 7/43 درصد نمونههای عفونی ادرار جدا شد [12]. در مطالعه محمدی و همکاران در سنندج نیز اشریشیاکلی بـا 63/9 درصـد، شـایعتـرین بـــاکتری جـــداشـــده از بیمـــاران مبتلا به عفونت ادراری بود [13]. نتایج مشابهی در مطالعات انجامشده در سایر کشورها به دست آمد [14، 15].
نتایج حاصل از این تحقیق نشان داد که شیوع عفونت ادراری در زنان به طور معنیداری بالاتر از مردان است. این نتایج با مطالعات انجامشده در ایران و سایر کشورها مطابقت دارد [14، 16]. نسبت مردان آلوده به زنان 1/96:1 بود. زنان به دلیل کلونیزاسیون مجرای ادرار با باکتریهای گرم منفی کلون که به دلیل نزدیکی مقعد و مجاری ادراری صورت میگیرد، بیشتر در معرض ابتلا به عفونت ادراری هستند [17]. همچنین اکثریت سویههای تولیدکننده ESBL نیز در بین زنان مشاهده شد (007/0=P). این نتایج با مطالعات انجامشده در ایران در سال 2018 (8/81 درصد)، نپال در سال 2017 (8/81 درصد) و هند در سال 2016 (4/62 درصد) مطابقت دارد [14، 18،19].
میزان شیوع سویههای ESBL مثبت در مطالعه ما 36 درصد بود که با مطالعات انجامشده در اصفهان در سال 2014 (36 درصد) مشابه بود [20]. شیوع پایینتری از اشرشیاکلی مولد ESBL در مطالعات بازی بورون و همکاران در سال 2018 (4/25 درصد) و اسلامی و همکاران در سال 2016 (30/5 درصد) مشاهده شد [18، 21]. شیوع سویههای مولد ESBL در نقاط مختلف دنیا، متفاوت گزارش شده است. میزان شیوع سویههای اشرشیاکلی مولد ESBL از 3/3 درصد در فرانسه تا 61 درصد در هند متغیر است [19، 22]. نتایج نشان میدهد شیوع سویههای ESBL در کشورهای مختلف و حتی در بیمارستانهای مختلف در یک شهر متفاوت است که این امر به دلیل تفاوت در رژیم درمانی به کار گرفتهشده در مناطق مختلف است. مصرف بیرویه آنتیبیوتیکها، بهویژه سفالوسپورینها از مهمترین عوامل شیوع بالای سویههای مولد ESBL است.
سویههای تولیدکننده ESBL مشکلات قابل توجهی را در درمان عفونتها ایجاد میکنند؛ زیرا این پاتوژنها به محدوده وسیعی از آنتیبیوتیکهای بتالاکتام شامل سفالوسپورینهای نسل سوم مقاومت نشان میدهند. به علاوه آنها به طور بالقوه دارای مقاومت کینولونی و کارباپنمی وابسته پلاسمید هستند [14]. مطالعات نشان داده سویههای تولیدکننده ESBL در برابر عوامل ضدمیکروبی نظیر تتراسایکلین، فلوروکینولونها، آمینوگلیکوزیدها و تری متوپریم سولفامتوکسازول نیز مقاوماند. الگوی مقاومت مشابهی در این مطالعه مشاهده شد. عوامل متعددی مسئول ایجاد چنین نرخ بالای مقاومت آنتیبیوتیکی هستند که شامل استفاده بیرویه از عوامل ضدمیکروبی در بیمارستانها و نیز خوددرمانی در جامعه است. در این مطالعه سویههای مولد ESBL مقاومت بالایی به سیپروفلوکساسین نشان دادند (78/75 درصد).
در مطالعات انجامگرفته توسط بازی بورون و همکاران، دوستی مهاجر و همکاران و نیز اسلامی و همکاران به ترتیب 61، 55 و 76 درصد سویههای اشرشیاکلی به سیپروفلوکساسین مقاوم بودند [18، 21، 23]. میزان شیوع مقاومت به سیپروفلوکساسین در کشورهای هند (6/82 درصد) و ترکیه (84 درصد) نیز بالا و مشابه نتایج این تحقیق بود [19، 24]. مطالعات انجامگرفته در ایران نشان داده که سیپروفلوکساسین بیش از سایر آنتیبیوتیکها برای درمان عفونتهای ادراری تجویز میشود [25] که این امر میتواند در افزایش شیوع ایزولههای مقاوم به این آنتیبیوتیک نقش داشته باشد. افزایش مقاومت به این دارو در مطالعه ما نشان میدهد که این دارو به عنوان داروی آنتیباکتریال تجربی نمیتواند اثربخشی لازم را داشته باشد. همچنین در سویههای مورد مطالعه در این تحقیق مقاومت بالایی در برابر آمینوگلیکوزیدها، کارباپنمها و کوتریموکسازول مشاهده شد و مقاومت به دست آمده نسبت به سایر مطالعات انجامشده در ایران و خارج از کشور بالاتر بود [18، 19، 20].
معمولاً تولید ESBL با مقاومت به چندین آنتیبیوتیک همراه است؛ زیرا ژنهای بتالاکتامازهای وسیعالطیف توسط پلاسمیدها رمز میشوند و این پلاسمیدها معمولاً ژنهای مقاومت به سایر آنتیبیوتیکها را نیز با خود حمل میکنند. یکی از یافتههای نگرانکننده در این تحقیق، مقاومت بالا نسبت به کار با پنمها است. اگرچه در اغلب مطالعات، ایمی پنم به عنوان داروی مناسب برای درمان عفونتهای ناشی از سویههای مولد ESBL ذکر شده است، اما ایزولههای مورد مطالعه در این تحقیق مقاومت بالایی به ایمی پنم داشتند (33 درصد). نتایج حاصل از این تحقیق با مطالعات بابایی همتی و همکاران (2015) و مهدی پور مقدم و همکاران (2015) در رشت (به ترتیب 36/36 و 33/33 درصد) مطابقت دارد [26، 27].
در مطالعه حاضر 85 ایزوله (2/47 درصد) دارای ژن TEM بودند. در مطالعه رضایی و همکاران فراوانی ژن TEM در بین ایزولههای ESBL مثبت 49 درصد گزارش شده بود [28] که با میزان شیوع ایزولههای مورد مطالعه در این تحقیق مطابقت دارد. به طور مشابه در مطالعات انجامشده در سال 2017 در هند 93/47 درصد ایزولههای مولد ESBL دارای ژن TEM بودند [29]. در حالی که شیوع ژنهای TEM در تایلند 31/93 درصد گزارش شده است [30]. آنتیبیوتیکهای مورد استفاده در هر بیمارستان با هر منطقه میتواند توزیع ژنوتیپهای مقاومت را تحت تأثیر قرار دهد. با توجه به اینکه حضور ژن TEM در تقریباً نیمی از ایزولههای ESBL مثبت به اثبات رسید، لازم است در مطالعات بعدی سایر ژنهای مسئول فنوتیپ ESBL نظیر SHV و CTX-M نیز بررسی شود.
نتیجهگیری
در این مطالعه باکتری اشرشیاکلی به عنوان شایعترین عامل عفونت ادراری جدا شد. میزان شیوع سویههای اشرشیاکلی مولد بتالاکتامازهای وسیعالطیف با مقاومت چنددارویی بالا بود. نتایج نشان داد که اکثریت سویههای ESBL در برابر اغلب آنتیبیوتیک هایی که در درمان عفونتهای ادراری به کار میروند، مقاوم هستند. همچنین نتایج حاصل از این تحقیق نشان داد که درصد بالایی از سویههای ESBL نسبت به ایمی پنم مقاوماند و ایمی پنم به عنوان داروی انتخابی در درمان عفونتهای ادراری تأثیر خود را از دست داده است. یافتههای حاضر باعث افزایش نگرانی در مورد انتشار سویههای اشرشیاکلی تولیدکننده ESBL میشود و بر تشخیص سویههای تولیدکننده ESBL در آزمایشگاههای تشخیص طبی و نظارت دقیق بر الگوهای مقاومت آنها تأکید دارد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با کد IR.IAU.TMU.REC.1396.274 به تصویب کمیته اخلاق پژوهشی دانشگاه علومپزشکی آزاد اسلامی تهران رسیده است.
حامی مالی
این مقاله برگرفته از پایان نامه خانم فریبا ادهم در مقطع کارشناسی ارشد رشته میکروبیولوژی است که با حمایت دانشگاه آزاد اسلامی واحد اسلامشهر انجام شده است
مشارکت نویسندگان
مفهوم سازی، روش شناسی، اعتبار سنجی، نظارت، تجزیه و تحلیل دادهها ، تهیه پیشنویس اولیه، ویرایش و بررسی: مریم قانع؛ تحقیق، منابع، آزمایش و تجزیه و تحلیل دادهها: فریبا ادهم.
تعارض منافع
بدینوسیله نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در خصوص این پژوهش وجود ندارد.
تشکر و قدردانی
بدینوسیله از پرسنل بیمارستانها و آزمایشگاه مرکزی شهرستان کرج برای تهیه نمونه قدردانی میشود.
میزان شیوع سویههای ESBL مثبت در مطالعه ما 36 درصد بود که با مطالعات انجامشده در اصفهان در سال 2014 (36 درصد) مشابه بود [20]. شیوع پایینتری از اشرشیاکلی مولد ESBL در مطالعات بازی بورون و همکاران در سال 2018 (4/25 درصد) و اسلامی و همکاران در سال 2016 (30/5 درصد) مشاهده شد [18، 21]. شیوع سویههای مولد ESBL در نقاط مختلف دنیا، متفاوت گزارش شده است. میزان شیوع سویههای اشرشیاکلی مولد ESBL از 3/3 درصد در فرانسه تا 61 درصد در هند متغیر است [19، 22]. نتایج نشان میدهد شیوع سویههای ESBL در کشورهای مختلف و حتی در بیمارستانهای مختلف در یک شهر متفاوت است که این امر به دلیل تفاوت در رژیم درمانی به کار گرفتهشده در مناطق مختلف است. مصرف بیرویه آنتیبیوتیکها، بهویژه سفالوسپورینها از مهمترین عوامل شیوع بالای سویههای مولد ESBL است.
سویههای تولیدکننده ESBL مشکلات قابل توجهی را در درمان عفونتها ایجاد میکنند؛ زیرا این پاتوژنها به محدوده وسیعی از آنتیبیوتیکهای بتالاکتام شامل سفالوسپورینهای نسل سوم مقاومت نشان میدهند. به علاوه آنها به طور بالقوه دارای مقاومت کینولونی و کارباپنمی وابسته پلاسمید هستند [14]. مطالعات نشان داده سویههای تولیدکننده ESBL در برابر عوامل ضدمیکروبی نظیر تتراسایکلین، فلوروکینولونها، آمینوگلیکوزیدها و تری متوپریم سولفامتوکسازول نیز مقاوماند. الگوی مقاومت مشابهی در این مطالعه مشاهده شد. عوامل متعددی مسئول ایجاد چنین نرخ بالای مقاومت آنتیبیوتیکی هستند که شامل استفاده بیرویه از عوامل ضدمیکروبی در بیمارستانها و نیز خوددرمانی در جامعه است. در این مطالعه سویههای مولد ESBL مقاومت بالایی به سیپروفلوکساسین نشان دادند (78/75 درصد).
در مطالعات انجامگرفته توسط بازی بورون و همکاران، دوستی مهاجر و همکاران و نیز اسلامی و همکاران به ترتیب 61، 55 و 76 درصد سویههای اشرشیاکلی به سیپروفلوکساسین مقاوم بودند [18، 21، 23]. میزان شیوع مقاومت به سیپروفلوکساسین در کشورهای هند (6/82 درصد) و ترکیه (84 درصد) نیز بالا و مشابه نتایج این تحقیق بود [19، 24]. مطالعات انجامگرفته در ایران نشان داده که سیپروفلوکساسین بیش از سایر آنتیبیوتیکها برای درمان عفونتهای ادراری تجویز میشود [25] که این امر میتواند در افزایش شیوع ایزولههای مقاوم به این آنتیبیوتیک نقش داشته باشد. افزایش مقاومت به این دارو در مطالعه ما نشان میدهد که این دارو به عنوان داروی آنتیباکتریال تجربی نمیتواند اثربخشی لازم را داشته باشد. همچنین در سویههای مورد مطالعه در این تحقیق مقاومت بالایی در برابر آمینوگلیکوزیدها، کارباپنمها و کوتریموکسازول مشاهده شد و مقاومت به دست آمده نسبت به سایر مطالعات انجامشده در ایران و خارج از کشور بالاتر بود [18، 19، 20].
معمولاً تولید ESBL با مقاومت به چندین آنتیبیوتیک همراه است؛ زیرا ژنهای بتالاکتامازهای وسیعالطیف توسط پلاسمیدها رمز میشوند و این پلاسمیدها معمولاً ژنهای مقاومت به سایر آنتیبیوتیکها را نیز با خود حمل میکنند. یکی از یافتههای نگرانکننده در این تحقیق، مقاومت بالا نسبت به کار با پنمها است. اگرچه در اغلب مطالعات، ایمی پنم به عنوان داروی مناسب برای درمان عفونتهای ناشی از سویههای مولد ESBL ذکر شده است، اما ایزولههای مورد مطالعه در این تحقیق مقاومت بالایی به ایمی پنم داشتند (33 درصد). نتایج حاصل از این تحقیق با مطالعات بابایی همتی و همکاران (2015) و مهدی پور مقدم و همکاران (2015) در رشت (به ترتیب 36/36 و 33/33 درصد) مطابقت دارد [26، 27].
در مطالعه حاضر 85 ایزوله (2/47 درصد) دارای ژن TEM بودند. در مطالعه رضایی و همکاران فراوانی ژن TEM در بین ایزولههای ESBL مثبت 49 درصد گزارش شده بود [28] که با میزان شیوع ایزولههای مورد مطالعه در این تحقیق مطابقت دارد. به طور مشابه در مطالعات انجامشده در سال 2017 در هند 93/47 درصد ایزولههای مولد ESBL دارای ژن TEM بودند [29]. در حالی که شیوع ژنهای TEM در تایلند 31/93 درصد گزارش شده است [30]. آنتیبیوتیکهای مورد استفاده در هر بیمارستان با هر منطقه میتواند توزیع ژنوتیپهای مقاومت را تحت تأثیر قرار دهد. با توجه به اینکه حضور ژن TEM در تقریباً نیمی از ایزولههای ESBL مثبت به اثبات رسید، لازم است در مطالعات بعدی سایر ژنهای مسئول فنوتیپ ESBL نظیر SHV و CTX-M نیز بررسی شود.
نتیجهگیری
در این مطالعه باکتری اشرشیاکلی به عنوان شایعترین عامل عفونت ادراری جدا شد. میزان شیوع سویههای اشرشیاکلی مولد بتالاکتامازهای وسیعالطیف با مقاومت چنددارویی بالا بود. نتایج نشان داد که اکثریت سویههای ESBL در برابر اغلب آنتیبیوتیک هایی که در درمان عفونتهای ادراری به کار میروند، مقاوم هستند. همچنین نتایج حاصل از این تحقیق نشان داد که درصد بالایی از سویههای ESBL نسبت به ایمی پنم مقاوماند و ایمی پنم به عنوان داروی انتخابی در درمان عفونتهای ادراری تأثیر خود را از دست داده است. یافتههای حاضر باعث افزایش نگرانی در مورد انتشار سویههای اشرشیاکلی تولیدکننده ESBL میشود و بر تشخیص سویههای تولیدکننده ESBL در آزمایشگاههای تشخیص طبی و نظارت دقیق بر الگوهای مقاومت آنها تأکید دارد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با کد IR.IAU.TMU.REC.1396.274 به تصویب کمیته اخلاق پژوهشی دانشگاه علومپزشکی آزاد اسلامی تهران رسیده است.
حامی مالی
این مقاله برگرفته از پایان نامه خانم فریبا ادهم در مقطع کارشناسی ارشد رشته میکروبیولوژی است که با حمایت دانشگاه آزاد اسلامی واحد اسلامشهر انجام شده است
مشارکت نویسندگان
مفهوم سازی، روش شناسی، اعتبار سنجی، نظارت، تجزیه و تحلیل دادهها ، تهیه پیشنویس اولیه، ویرایش و بررسی: مریم قانع؛ تحقیق، منابع، آزمایش و تجزیه و تحلیل دادهها: فریبا ادهم.
تعارض منافع
بدینوسیله نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در خصوص این پژوهش وجود ندارد.
تشکر و قدردانی
بدینوسیله از پرسنل بیمارستانها و آزمایشگاه مرکزی شهرستان کرج برای تهیه نمونه قدردانی میشود.
References
Jena J, Debata N K, Subudhi E. Prevalence of extended-spectrum-beta-lactamase and metallo-beta-lactamase producing multi drug resistance gram- negative bacteria from urinary isolates. Indian J Med Microbiol. 2013; 3(31):420-1. [DOI:10.4103/0255-0857.118890] [PMID]
Gonzalez CM, Schaeffer AJ. Treatment of urinary tract infection: What’s old, what’s new, and what works. World J Urol. 1999; 17(6):372-82. [DOI:10.1007/s003450050163] [PMID]
Pitout JD, Sanders CC, Sanders WE. Antimicrobial resistance with focus on beta-lactam resistance in gram-negative bacilli. Am J Med. 1997; 103:51-9. [DOI:10.1016/S0002-9343(97)00044-2]
Worthington RJ, Melander C. Overcoming resistance to β-lactam antibiotics. J Org Chem. 2013; 78(9):4207-13. [DOI:10.1021/jo400236f] [PMID] [PMCID]
Bagattini M, Crivaro V, Di Popolo A, Gentile F, Scarcella A, Triassi M, et al. Molecular epidemiology of extended-spectrum beta-lactamase-producing Klebsiella pneumoniae in a neonatal intensive care unit. J Antimicrob Chemother. 2006; 57(5):979-82. [DOI:10.1093/jac/dkl077] [PMID]
Tenover FC, Raney PM, Williams PP, Rasheed JK, Biddle JW, Oliver A, et al. Evaluation of the NCCLS extended-spectrum β-lactamase confirmation methods for Escherichia coli with isolates collected during project ICARE. J Clin Microbiol. 3003; 41(7):3142-6. [DOI:10.1128/JCM.41.7.3142-3146.2003] [PMID] [PMCID]
Tada T, Shrestha S, Shimada K, Ohara H, Sherchand JB, Pokhrel BM, et al. PER-8, a novel extended-spectrum β-lactamase per variant, from an Acinetobacter baumannii clinical isolate in Nepal. Antimicrob Agents Chemother. 2017; 23:61(3). [DOI:10.1128/AAC.02300-16] [PMID] [PMCID]
Versalovic J, Carroll KC, Funke G, Jorgensen JH, Landry ML, Warnock DW. Manual of clinical microbiology. 10th ed. Washington D.C: American Society of Microbiology; 2011. [DOI:10.1128/9781555816728]
Wayne P. M100 Performance standards for antimicrobial susceptibility testing 27th ed. Wayne: Clinical and Laboratory Standards Institute (CLSI); 2017.
Monstain HJ, Ostholm- Balkhed A, Nilsson MV, Nilsson M, Dornbusch K, Nilsson LE. Multiplex amplification assay for detection of blaSHV, blaTEM and blaCTX-M genes in Enterobacteriaceae. APMIS. 2007; 115(12):1400-8. [DOI:10.1111/j.1600-0463.2007.00722.x] [PMID]
Weldhagen GF, Poirel L, Nordmann P. Ambler class A extended-spectrum beta-lactamases in Pseudomonas aeruginosa: novel developments and clinical impact. Antimicrob Agents Chemother. 2003; 47(8):2385-92. [DOI:10.1128/AAC.47.8.2385-2392.2003] [PMID] [PMCID]
Jabrodini A, Heidari F, Taghavi SF, Shokouh MR. [The investigation of frequency and antibiotic resistance pattern of Escherichia coli and Klebsiella pneumoniae Isolated from urinary tract infection in outpatients referred to Amiralmomenin Ali hospital in Gerash city in 2017: A short Report (Persian)]. J Rafsanjan Univ Med Sci. 2018; 17:(1)75-84.
Mohammadi S, Ramazanzade R, Zandi S, Rouhi S, Mohammadi B. [Determination of prevalence of isolated bacteria from urinary tracts and antibiotic resistant pattern of them in Tohid hospital of Sanandaj (2013-2014) (Persian)]. Zanko J Med Sci. 2015; 50(16):55-62.
Shakya P, Shrestha D, Maharjan E, Sharma VK, Paudyal R. ESBL production among E. coli and Klebsiella spp. causing urinary tract infection: A hospital based study. Open Microbiol J. 2017; 11:23-30. [DOI:10.2174/1874285801711010023] [PMID] [PMCID]
Khawcharoenporn T, Vasoo S, Singh K. Urinary tract infections due to multidrug-resistant enterobacteriaceae: Prevalence and risk factors in a Chicago emergency department. Emerg Med Int. 2013; 2013:258517. [DOI:10.1155/2013/258517] [PMID] [PMCID]
Molazade A, Gholami MS , Shahi A, Najafipour S, Mobasheri F, Ashraf Mansuri JA. et al. [Evaluation of antibiotic resistance pattern of isolated gram-negative bacteria from urine culture of hospitalized patients in different wards of vali asr hospital in Fasa during the years 2012 and 2013 (Persian)]. J Fasa Univ Med Sci. 2014; 4(2):275-83.
Forbes BA, Sahm DF, Weissfeld AS. Bailey & Scott’s Diagnostic Microbiology. 12th ed. Maryland Heights: Mosby Elsevier; 2007.
Baziboroun M, Bayani M, Poormontaseri Z, Shokri M, Tahmineh Biazar T. Prevalence and antibiotic susceptibility pattern of extended spectrum beta lactamases producing Escherichia coli isolated from outpatients with urinary tract infections in Babol, northern of Iran. Curr Issues Pharm Med Sci. 2018; 31(2):61-4. [DOI:10.1515/cipms-2018-0013]
Singh N, Pattnaik D, Neogi DK, Jena J, Mallick B. Prevalence of ESBL in Escherichia coli isolates among ICU patients in a tertiary care hospital. J Clin Diagn Res. 2016; 10(9):19-22. [DOI:10.7860/JCDR/2016/21260.8544] [PMID] [PMCID]
Moayednia R, Shokri D, Mobasherizadeh S, Baradaran A, Fatemi SM, Merrikhi A. Frequency assessment of β-lactamase enzymes in Escherichia coli and Klebsiella isolates in patients with urinary tract infection. J Res Med Sci. 2014; 19(Suppl. 1):S41-5. [PMID] [PMCID]
Eslami G, Rezaie MS, Salehifar E, Rafiei A, Langaie T, Rafati M, et al. [Epidemiology of extended spectrum beta lactamases producing E. coli genes in strains isolated from children with urinary tract infection in north of Iran (Persian)]. J Mazandaran Univ Med Sci. 2016; 25(132):270-9.
Martin D, Fougnot S, Grobost F, Thibaut-Jovelin S, Ballereau F, Gueudet T, et al. Prevalence of extended-spectrum beta-lactamase producing Escherichia coli in community-onset urinary tract infections in France in 2013. J Infect. 2016; 72(2):201-6. [DOI:10.1016/j.jinf.2015.11.009] [PMID]
Doosti Mohajer M, Pajavand H, Abiri R, Alvand A. [Phenotypic and Genotypic Efflux pumps in resistance to Fluoroquinolonesin E.coli isolated from inpatientsin Kermanshah hospitals in 2013 (Persian)]. Arak Med Uni J. 2017; 20(126):22-32.
Azap OK, Arslan H, Serefhanoğlu K, Colakoğlu S, Erdoğan H, Timurkaynak F, et al. Risk factors for extended-spectrum beta-lactamase positivity in uropathogenic Escherichia coli isolated from community-acquired urinary tract infections. Clin Microbiol Infect. 2010; 16(2):147-51. [DOI:10.1111/j.1469-0691.2009.02941.x] [PMID]
Hashemi S, Nasrollah A, Rajabi M. Irrational antibiotic prescribing: A local issue or global concern? EXCLI J. 2013; 12:384-95. [PMID] [PMCID]
Babaei Hemmati T, Mehdipour Moghaddam MJ, Salehi Z, Habibzadeh SM. Prevalence of CTX-M-Type β-lactamases in multi-drug resistant Escherichia coli isolates from north of Iran, Rasht. Biol J Microorg. 2015; 3:69-78.
Mehdipour Moghaddam MJ, Mirbagheri AA, Salehi Z, Habibzade SM. Prevalence of class 1 integrons and extended spectrum beta lactamases among multi-drug resistant Escherichia coli isolates from north of Iran. Iran Biomed J. 2015; 19(4):233-9. [DOI:10.7508/ibj.2015.04.007] [PMID] [PMCID]
Rezai MS, Salehifar E, Rafiei A, Langaee T, Rafati M, Shafahi K, et al. Characterization of multidrug resistant extended-spectrum beta-lactamase-producing Escherichia coli among Uropathogens of pediatrics in north of Iran. Biomed Res Int. 2015; 2015:309478 [DOI:10.1155/2015/309478] [PMID] [PMCID]
Jena J, Sahoo RK, Debata NK, Subudhi E. Prevalence of TEM, SHV, and CTX-M genes of extended-spectrum β-lactamase-producing Escherichia coli strains isolated from urinary tract infections in adults. 3 Biotech. 2017; 7(4):244. [DOI:10.1007/s13205-017-0879-2] [PMID] [PMCID]
Bubpamala J, Khuntayaporn P, Thirapanmethee K, Montakantikul P, Santanirand P, Chomnawang MT. Phenotypic and genotypic characterizations of extended-spectrum beta-lactamase-producing Escherichia coli in Thailand. Infect Drug Resist. 2018; 11: 2151-7. [DOI:10.2147/IDR.S174506] [PMID] [PMCID]
Jena J, Debata N K, Subudhi E. Prevalence of extended-spectrum-beta-lactamase and metallo-beta-lactamase producing multi drug resistance gram- negative bacteria from urinary isolates. Indian J Med Microbiol. 2013; 3(31):420-1. [DOI:10.4103/0255-0857.118890] [PMID]
Gonzalez CM, Schaeffer AJ. Treatment of urinary tract infection: What’s old, what’s new, and what works. World J Urol. 1999; 17(6):372-82. [DOI:10.1007/s003450050163] [PMID]
Pitout JD, Sanders CC, Sanders WE. Antimicrobial resistance with focus on beta-lactam resistance in gram-negative bacilli. Am J Med. 1997; 103:51-9. [DOI:10.1016/S0002-9343(97)00044-2]
Worthington RJ, Melander C. Overcoming resistance to β-lactam antibiotics. J Org Chem. 2013; 78(9):4207-13. [DOI:10.1021/jo400236f] [PMID] [PMCID]
Bagattini M, Crivaro V, Di Popolo A, Gentile F, Scarcella A, Triassi M, et al. Molecular epidemiology of extended-spectrum beta-lactamase-producing Klebsiella pneumoniae in a neonatal intensive care unit. J Antimicrob Chemother. 2006; 57(5):979-82. [DOI:10.1093/jac/dkl077] [PMID]
Tenover FC, Raney PM, Williams PP, Rasheed JK, Biddle JW, Oliver A, et al. Evaluation of the NCCLS extended-spectrum β-lactamase confirmation methods for Escherichia coli with isolates collected during project ICARE. J Clin Microbiol. 3003; 41(7):3142-6. [DOI:10.1128/JCM.41.7.3142-3146.2003] [PMID] [PMCID]
Tada T, Shrestha S, Shimada K, Ohara H, Sherchand JB, Pokhrel BM, et al. PER-8, a novel extended-spectrum β-lactamase per variant, from an Acinetobacter baumannii clinical isolate in Nepal. Antimicrob Agents Chemother. 2017; 23:61(3). [DOI:10.1128/AAC.02300-16] [PMID] [PMCID]
Versalovic J, Carroll KC, Funke G, Jorgensen JH, Landry ML, Warnock DW. Manual of clinical microbiology. 10th ed. Washington D.C: American Society of Microbiology; 2011. [DOI:10.1128/9781555816728]
Wayne P. M100 Performance standards for antimicrobial susceptibility testing 27th ed. Wayne: Clinical and Laboratory Standards Institute (CLSI); 2017.
Monstain HJ, Ostholm- Balkhed A, Nilsson MV, Nilsson M, Dornbusch K, Nilsson LE. Multiplex amplification assay for detection of blaSHV, blaTEM and blaCTX-M genes in Enterobacteriaceae. APMIS. 2007; 115(12):1400-8. [DOI:10.1111/j.1600-0463.2007.00722.x] [PMID]
Weldhagen GF, Poirel L, Nordmann P. Ambler class A extended-spectrum beta-lactamases in Pseudomonas aeruginosa: novel developments and clinical impact. Antimicrob Agents Chemother. 2003; 47(8):2385-92. [DOI:10.1128/AAC.47.8.2385-2392.2003] [PMID] [PMCID]
Jabrodini A, Heidari F, Taghavi SF, Shokouh MR. [The investigation of frequency and antibiotic resistance pattern of Escherichia coli and Klebsiella pneumoniae Isolated from urinary tract infection in outpatients referred to Amiralmomenin Ali hospital in Gerash city in 2017: A short Report (Persian)]. J Rafsanjan Univ Med Sci. 2018; 17:(1)75-84.
Mohammadi S, Ramazanzade R, Zandi S, Rouhi S, Mohammadi B. [Determination of prevalence of isolated bacteria from urinary tracts and antibiotic resistant pattern of them in Tohid hospital of Sanandaj (2013-2014) (Persian)]. Zanko J Med Sci. 2015; 50(16):55-62.
Shakya P, Shrestha D, Maharjan E, Sharma VK, Paudyal R. ESBL production among E. coli and Klebsiella spp. causing urinary tract infection: A hospital based study. Open Microbiol J. 2017; 11:23-30. [DOI:10.2174/1874285801711010023] [PMID] [PMCID]
Khawcharoenporn T, Vasoo S, Singh K. Urinary tract infections due to multidrug-resistant enterobacteriaceae: Prevalence and risk factors in a Chicago emergency department. Emerg Med Int. 2013; 2013:258517. [DOI:10.1155/2013/258517] [PMID] [PMCID]
Molazade A, Gholami MS , Shahi A, Najafipour S, Mobasheri F, Ashraf Mansuri JA. et al. [Evaluation of antibiotic resistance pattern of isolated gram-negative bacteria from urine culture of hospitalized patients in different wards of vali asr hospital in Fasa during the years 2012 and 2013 (Persian)]. J Fasa Univ Med Sci. 2014; 4(2):275-83.
Forbes BA, Sahm DF, Weissfeld AS. Bailey & Scott’s Diagnostic Microbiology. 12th ed. Maryland Heights: Mosby Elsevier; 2007.
Baziboroun M, Bayani M, Poormontaseri Z, Shokri M, Tahmineh Biazar T. Prevalence and antibiotic susceptibility pattern of extended spectrum beta lactamases producing Escherichia coli isolated from outpatients with urinary tract infections in Babol, northern of Iran. Curr Issues Pharm Med Sci. 2018; 31(2):61-4. [DOI:10.1515/cipms-2018-0013]
Singh N, Pattnaik D, Neogi DK, Jena J, Mallick B. Prevalence of ESBL in Escherichia coli isolates among ICU patients in a tertiary care hospital. J Clin Diagn Res. 2016; 10(9):19-22. [DOI:10.7860/JCDR/2016/21260.8544] [PMID] [PMCID]
Moayednia R, Shokri D, Mobasherizadeh S, Baradaran A, Fatemi SM, Merrikhi A. Frequency assessment of β-lactamase enzymes in Escherichia coli and Klebsiella isolates in patients with urinary tract infection. J Res Med Sci. 2014; 19(Suppl. 1):S41-5. [PMID] [PMCID]
Eslami G, Rezaie MS, Salehifar E, Rafiei A, Langaie T, Rafati M, et al. [Epidemiology of extended spectrum beta lactamases producing E. coli genes in strains isolated from children with urinary tract infection in north of Iran (Persian)]. J Mazandaran Univ Med Sci. 2016; 25(132):270-9.
Martin D, Fougnot S, Grobost F, Thibaut-Jovelin S, Ballereau F, Gueudet T, et al. Prevalence of extended-spectrum beta-lactamase producing Escherichia coli in community-onset urinary tract infections in France in 2013. J Infect. 2016; 72(2):201-6. [DOI:10.1016/j.jinf.2015.11.009] [PMID]
Doosti Mohajer M, Pajavand H, Abiri R, Alvand A. [Phenotypic and Genotypic Efflux pumps in resistance to Fluoroquinolonesin E.coli isolated from inpatientsin Kermanshah hospitals in 2013 (Persian)]. Arak Med Uni J. 2017; 20(126):22-32.
Azap OK, Arslan H, Serefhanoğlu K, Colakoğlu S, Erdoğan H, Timurkaynak F, et al. Risk factors for extended-spectrum beta-lactamase positivity in uropathogenic Escherichia coli isolated from community-acquired urinary tract infections. Clin Microbiol Infect. 2010; 16(2):147-51. [DOI:10.1111/j.1469-0691.2009.02941.x] [PMID]
Hashemi S, Nasrollah A, Rajabi M. Irrational antibiotic prescribing: A local issue or global concern? EXCLI J. 2013; 12:384-95. [PMID] [PMCID]
Babaei Hemmati T, Mehdipour Moghaddam MJ, Salehi Z, Habibzadeh SM. Prevalence of CTX-M-Type β-lactamases in multi-drug resistant Escherichia coli isolates from north of Iran, Rasht. Biol J Microorg. 2015; 3:69-78.
Mehdipour Moghaddam MJ, Mirbagheri AA, Salehi Z, Habibzade SM. Prevalence of class 1 integrons and extended spectrum beta lactamases among multi-drug resistant Escherichia coli isolates from north of Iran. Iran Biomed J. 2015; 19(4):233-9. [DOI:10.7508/ibj.2015.04.007] [PMID] [PMCID]
Rezai MS, Salehifar E, Rafiei A, Langaee T, Rafati M, Shafahi K, et al. Characterization of multidrug resistant extended-spectrum beta-lactamase-producing Escherichia coli among Uropathogens of pediatrics in north of Iran. Biomed Res Int. 2015; 2015:309478 [DOI:10.1155/2015/309478] [PMID] [PMCID]
Jena J, Sahoo RK, Debata NK, Subudhi E. Prevalence of TEM, SHV, and CTX-M genes of extended-spectrum β-lactamase-producing Escherichia coli strains isolated from urinary tract infections in adults. 3 Biotech. 2017; 7(4):244. [DOI:10.1007/s13205-017-0879-2] [PMID] [PMCID]
Bubpamala J, Khuntayaporn P, Thirapanmethee K, Montakantikul P, Santanirand P, Chomnawang MT. Phenotypic and genotypic characterizations of extended-spectrum beta-lactamase-producing Escherichia coli in Thailand. Infect Drug Resist. 2018; 11: 2151-7. [DOI:10.2147/IDR.S174506] [PMID] [PMCID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |