دوره 22، شماره 6 - ( بهمن و اسفند 1398 )
جلد 22 شماره 6 صفحات 191-182 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Zabihi E, Motavallibashi S E, Panahpour1 H, Sheikhkanloui Milan H. Effect of Hydroalcoholic Extract of Truffle (Terfezia Boudieri) on Serum Level of Thyroid Hormones in Male Rats. J Arak Uni Med Sci 2020; 22 (6) :182-191
URL: http://jams.arakmu.ac.ir/article-1-6078-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6078-fa.html
ذبیحی اسلام، متولی باشی سید اقبال، پناهپور حمدالله، شیخکانلوی میلان حمید. اثر عصاره هیدروالکلی قارچ دنبلان(Terfezia boudieri) بر سطح سرمی هورمون های تیرویید و محور هیپوفیز - تیروئید در موش صحرایی نر. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (6) :182-191
1- گروه فیزیولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی اردبیل، اردبیل
2- گروه بیوشیمی، دانشکده پزشکی، دانشگاه علوم پزشکی اردبیل، اردبیل
3- گروه فیزیولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی اردبیل، اردبیل ،hshmilan@gmail.com
2- گروه بیوشیمی، دانشکده پزشکی، دانشگاه علوم پزشکی اردبیل، اردبیل
3- گروه فیزیولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی اردبیل، اردبیل ،
متن کامل [PDF 2084 kb]
(1506 دریافت)
| چکیده (HTML) (5275 مشاهده)
در مقایسه گروه کنترل و شم، اختلاف معنیداری مشاهده نشد. در طول تحقیق 14روزه با دزهای mg/kg 300 و 150 ،75 سمیتی از قارچ دنبلان کوهی (افتادگی سر، ریزش مو، سیخشدن مو، لرزش، تعریق، اسهال و کاهش وزن) بر روی موشهای صحرایی مشاهده نشد.
بحث
مطالعه حاضر نشان داد که عصاره هیدروالکلی قارچ دنبلان توانست بدون تغییر در وزن موش صحرایی، سطح سرمی هورمونهای تیروئیدی را افزایش و میزان TSH را کاهش دهد. مطالعات قبلی بیانگر آن است که فلاونوئیدها با ممانعت از فعالیت آنزیم تیروپراکسیداز (TPO) بر عملکرد تیروئید تأثیر گذاشته و باعث کاهش سطح هورمونهای تیروئیدی میشوند [10، 13]. همچنین مطالعات گذشته نشان داده است که مشتقات کومارینی و آنتیاکسیدانها باعث افزایش سطح هورمونهای تیروئیدی میشوند [19، 20].
قارچ دنبلان حاوی ترکیباتی است که میتواند اثرات متناقضی بر روی تیروئید داشته باشد. نتایج این تحقیق نشان داد که سطح سرمی هورمونهای تیروئیدی احتمالاً تحت تأثیر ترکیبات کومارینی و آنتیاکسیدانی افزایش مییابد.
تحقیقات انجامشده روی نقش آنتیاکسیدان بر روی هورمونهای تیروئیدی نشان داد که رژیم غذایی با آنتیاکسیدانهای طبیعی ویتامین E و C میزان سرمی T4 و T3 را با تأثیرمستقیم آنتیاکسیدانها برروی غده تیروئید و یا فعالیت آنزیم دیدیناز افزایش میدهد [19]. همچنین در مطالعات مشابهی اثبات شده است که آنتیاکسیدانها، ویتامین C و E اثر مثبت بر غده تیروئید دارند و عصارههایی با ترکیبات فوق توانسته است کاهش القایی سطح هورمونهای تیروئید در موش را جبران کند [21].
از طرف دیگر، مطالعه آشتیانی چنگیزی و همکارانش نشان داد که گیاهانی که حاوی مقادیر زیادی اسیدهای چرب امگا 3، آلفالینوئیک اسید و انواع اسیدهای آمینه، ویتامینها و کاروتنوئیدهاست [22] میتواند غلظت هورمونهای تیروئیدی را افزایش و میزان TSH را کاهش دهد [23-22].
در خصوص علت افزایش غلظت هورمونهای تیروئیدی در گروههای دریافتکننده عصاره هیدروالکی قارچ دنبلان در مطالعه حاضر، احتمالاً قارچ دنبلان با داشتن ترکیبات مشابه و تنوع گستردهای از مواد مؤثره آنتیاکسیدان [17] قادر است با تحریک غده تیروئید باعث افزایش هورمونهای تیروئید شود که نشان میدهد یافتههای ما با مطالعات گذشته مطابقت دارد.
از طرفی کلسیم برای اکسیداسیون I- به I2 ضروری است [23] و عمل اکسیداسیون ید در غده تیروئید با استفاده از پراکسید هیدروژن ((H2O2 به عنوان سوبسترای اکسیدکننده انجام میشود؛ به طوری که در صورت کاهش کلسیم تولید H2O2 دچار اختلال میشود [24].
با توجه به اینکه قارچ دنبلان حاوی مواد معدنی کلسیم، روی، آهن و غیره [17] است، بنابراین احتمال دارد قارچ دنبلان با افزایش غلظت کلسیم و تبدیل I- به I2 و درنهایت تولید H2O2 بیشتر، سطح هورمونهای تیروئیدی را افزایش داده است.
یکی دیگر از نتایج این پژوهش کاهش سطح سرمی TSH بود. مطالعات انجامشده نشان داده است که اسید فرولیک با بالابردن سطح انسولین [25، 26] و همچنین IGF-1، قند خون را کاهش میدهد. با توجه به اینکه ترشح سوماتواستاتین هم تحت تأثیر فاکتور رشد شبهانسولین نوع اول (IGF-I) افزایش مییابد و اثر مهاری بر ترشح هورمونهای آزادکننده تیروتوروپین (TRH) دارد [27] و به دلیل اینکه فرولیک اسید یکی از ترکیبات فعال موجود در دنبلان است [15]، احتمال دارد دنبلان با همین مکانیسم میزان TSH را کاهش داده باشد.
از طرف دیگر ساخت و ترشح هورمونهای تیروئیدی توسط محور هورمونی هیپوتالاموس هیپوفیز کنترل میشود. هورمون آزادکننده تیروتروپین (TRH) از هسته پارا ونتریکولار هیپوتالاموس آزاد شده و با تأثیر بر روی هیپوفیز قدامی باعث ترشح هورمون TSH میشود و درنهایت TSH، ترشح هورمونهای T3 و T4 را تحت تأثیر خود قرار میدهد. کاهش میزان TSH، احتمالاً با مکانیسم بازخورد منفی موجود در محور هیپوتالاموسی هیپوفیزی تیروئیدی به دنبال افزایش غلظت سرمی هورمونهای تیروئیدی است [4]؛ بنابراین کاهش هورمون TSH ناشی از افزایش هورمونهای تیروئیدی در مطالعه حاضر قابل انتظار است.
این مطالعه نشان داد که عصاره هیدروالکلی قارچ دنبلان نتوانست وزن موشهای صحرایی مورد آزمایش را به صورت معنیدار افزایش دهد. مطالعات قبلی بیانگر آن است که فیتواسترولها باعث افزایش دی هیدرو اپی آندرسترون (DHEA) میشوند که این ترکیب باعث افزایش سوخت چربیها و کاهش ذخیره آنها در بافت میشود که به موجب آن جذب چربیها مهار شده و از این طریق باعث کاهش وزن بدن میشود. از طرف دیگر DHEA باعث تحریک تولید پروتئینهای ماهیچهای میشود که اثر کاهش وزن بدن را تا حدودی بهبود میبخشد [28]. از آنجایی که پژوهشهای گذشته نشان داده است وزن بدن و بیضهها تحت تأثیر هورمون تستسترون قرار دارد [29] و از طرفی ثابت شده است که قارچ دنبلان باعث افزایش تستسترون میشود [30]؛ بنابراین احتمال دارد عصاره دنبلان با همین مکانیسم باعث افزایش وزن موش شده است، ولی به دلیل کوتاهبودن دوره آزمایش، این افزایش معنیدار نبوده است.
نتیجهگیری
نتایج تحقیق حاضر نشان داد که عصاره هیدروالکلی قارچ دنبلان با تأثیر بر عملکرد غده تیروئید باعث افزایش هورمونهای تیروئیدی در موشهای صحرایی شده است. افزایش سطح سرمی هورمونهای تیروئید، احتمالاً به خاطر وجود مواد مؤثر، از جمله ترکیبات مشابه امگا 3، آنتیاکسیدانتها و مواد معدنی در قارچ دنبلان است. کاهش سطح سرمی TSH، ممکن است به علت فیدبک منفی هورمونهای تیروئید باشد. با توجه به نتایج این تحقیق، احتمالاً میتوان از این قارچ برای افزایش سطح هورمون T3 و T4 استفاده کرد. دستیافتن به چگونگی مکانیسم این اثرات و توصیه به استفاده از قارچ برای افزایش سطح هورمون تیروئیدی، نیازمند مطالعات بیشتر روی غده تیروئید و عوامل سلولی و مولکولی آن است. پیشنهاد میشود تأثیر این قارچ بر روی بافت غده تیروئید در مطالعات بعدی بررسی شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش در کمیته اخلاقی دانشگاه علومپزشکی اردبیل با کد IR-ARUMS-REC-1396-48 تصویب شده است.
حامی مالی
معاونت پژوهشی دانشگاه علومپزشکی از این مقاله حمایت مالی کرده است.
مشارکت نویسندگان
تمامی نویسندگان در نگارش مقاله به یک اندازه سهیم بودهاند.
تعارض منافع
تمامی نویسندگان اعلام میدارند که هیچگونه تضاد منافعی در خصوص این مطالعه وجود ندارد.
تشکر و قدردانی
این طرح در دانشگاه علومپزشکی اردبیل با کد شناسایی 9604 به تصویب رسیده است، بدینوسیله نویسندگان مقاله از معاونت پژوهشی دانشگاه علومپزشکی و خانم دکتر سعادتی به خاطر راهنمایی ارزندهشان تشکر و قدردانی میکنند.
متن کامل: (2491 مشاهده)
مقدمه
تیروئید یکی از غدد درونریز بدن و مسئول تنظیم اعمال مهمی است [1]. هورمونهای تیروئیدی در حفظ هموستاز انرژی، متابولیسم، تحریک فعالیت سلولها و همچنین در نمو، تمایز و بلوغ نقش ویژهای دارند. عقبماندگی ذهنی در کودکانی که کمبود هورمونهای تیروئیدی دارند، اهمیت این هورمون را مشخص میکند [2]. عدم ترشح تیروئید، باعث کاهش متابولیسم پایه به میزان 40 تا 50 درصد کمتر از حد طبیعی میشود و ترشح بیش از حد آن هم میتواند متابولیسم پایه را 60 تا 100 درصد بیشتر از حد طبیعی افزایش دهد. هورمون محرک تیروئید (TSH) که از غده هیپوفیز قدامی ترشح میشود کنترل ترشح تیروئید را برعهده دارد [3، 4]. بنابراین با توجه بروز عوارض مرتبط با افزایش و کاهش سطح سرمی هورمونهای تیروئید که میتوانند زندگی افراد را تهدید کنند، حفط هورمونها در سطح نرمال ضروری است. درمان هیپوتیروئیدی، به حد طبیعی رساندن سطح هورمونهای تیروئید در بافتهای محیطی است. در حال حاضر داروی لووتیروکسین در درمان هیپوتیروئیدیسم استفاده میشود [5].
امروزه استفاده از گیاهان دارویی در پیشگیری و درمان بیمار یها روند رو به رشدی دارد. در سا لهای گذشته و در برخی موارد داروهای طبیعی ب هخصوص گیاهان دارویی، تنها وسیله درمان محسوب م یشدند ] 7 ، 6[. در سه دهه گذشته استفاده از داروهای گیاهی و احیای طب سنتی در ایران نیز رواج پیدا کرده است ] 8[. مطالعات انجا مشده نشان م یدهد که ترکیبات فنولی، حاوی آنتیاکسیدانهای مؤثری در خنثیکردن رادیکالهای اکسیژندار هستند [9]. فلاونوئیدها با مهار فعالیت آنزیم دیدیناز نوع I و ممانعت از معدنیشدن ید در سلولهای تیروئید، هورمونهای تیروئید را تغییر میدهند [10، 11]. مطالعات گذشته نشان داده است که ترکیبات استروئیدی وکومارینی میتوانند بر هورمونهای محور هیپوفیز تیروئید تأثیرگذار باشند [12-14].
قارچ دنبلان شامل ترکیبات فلاونوئیدی، ترکیبات آنتیاکسیدان، ویتامینها، کارتنوئید و ترکیبات کومارینی و یونهای معدنی نظیر کلسیم، روی، آهن، مس و غیره است [15-17]. مطالعات قبلی نشان داده است که قارچ دنبلان بودیری در مبتلایان به دیابت باعث کاهش قند خون شده [18] و تأثیرات آنتیاکسیدانی و آنتیبیوتیکی در برابر میکروبها و انواع سرطانها دارد [15، 17]. با توجه به ترکیبات متنوع فلاونوئیدی، کومارینی و آنتیاکسیدانی موجود در این قارچ، تحقیق حاضر با هدف ارزیابی تأثیر عصاره هیدروالکلی قارچ دنبلان بر سطح هورمونهای تیروئیدی در موش صحرایی نر انجام شد.
مواد و روشها
موشهای صحرایی نر بالغ نژاد ویستار با وزن 200±10 گرم از حیوانخانه دانشگاه علومپزشکی اردبیل انتخاب شدند. حیوانات در دمای حدود 22±2 درجه سانتیگراد و با دوره نوری 12 ساعت روشنایی و 12 ساعت تاریکی نگهداری شدند. قبل از مطالعه و در طول مطالعه آب شهری در اختیار حیوانات قرار گرفت و رژیم غذایی نرمال برایشان اعمال شد.
در این مطالعه قارچ دنبلان از شهرستان پارسآباد استان اردبیل جمعآوری شد. قارچ بعد از خشکشدن با دستگاه آسیاب برقی پودر شد. یک لیتر آب و اتانول (نسبت 3 به 7) به هر 100 گرم پودر قارچ دنبلان افزوده شد تا در مدت 48 ساعت خیس شود و هر 6 ساعت به مدت 20 دقیقه روی شیکر قرار گرفت. بعد از عبوردادن عصاره از صافی واتمن، آب و الکل آن تبخیر شد. سپس عصاره خشکشده برای تهیه غلظتهای مختلف با سرم فیزیولوژی (حلال عصاره) مخلوط شد.
30 سر موش صحرایی نر مورد آزمایش در این مطالعه، به پنج گروه ششتایی تقسیم شدند. گروه کنترل، هیچچیز دریافت نکردند. گروه شم (سرم فیزیولوژی) و گروههای آزمایش 3 ،2 ،1 به ترتیب دریافتکننده دزهای 75، 150 و 300 mg/kg عصاره هیدروالکلی قارچ دنبلان بودند. عصاره به صورت داخل صفاقی و به مدت 14 روز تجویز شد.
24 ساعت پس از آخرین روز تجویز عصاره، حیوانات با ترازوی دیجیتال وزنکشی شده و سپس با کتامین ( 100 mg/kg) و زایلازین (01 mg/kg) تهیه شده از شرکت Alfasan هلند بیهوش شدند. سپس پوست ناحیه قفسه سینه، جناغ و دنده برش داده شد و خونگیری به صورت مستقیم از بطن چپ قلب انجام گرفت. جهت به دست آوردن سرم، نمونههای خونی پنج دقیقه با دور 3500، سانتریفیوژ شدند و سرم تا انجام آزمایش در دمای منهای 20 درجه نگهداری شد. سنجش هورمونها با استفاده از کیت Mono Bind (ساخت کشور آمریکا) و طبق دستورالعمل شرکت سازنده آن اندازهگیری شد.
تحلیل آماری
نتایج به صورت میانگین±انحراف معیار گزارش شد. دادهها با استفاده از نسخه 21 نرمافزار SPSS و از طریق آزمون آماری ANOVA یکطرفه و تست تعقیبی توکی در سطح معنیداری P<0/05 مورد تحلیل آماری قرار گرفتند.
یافتهها
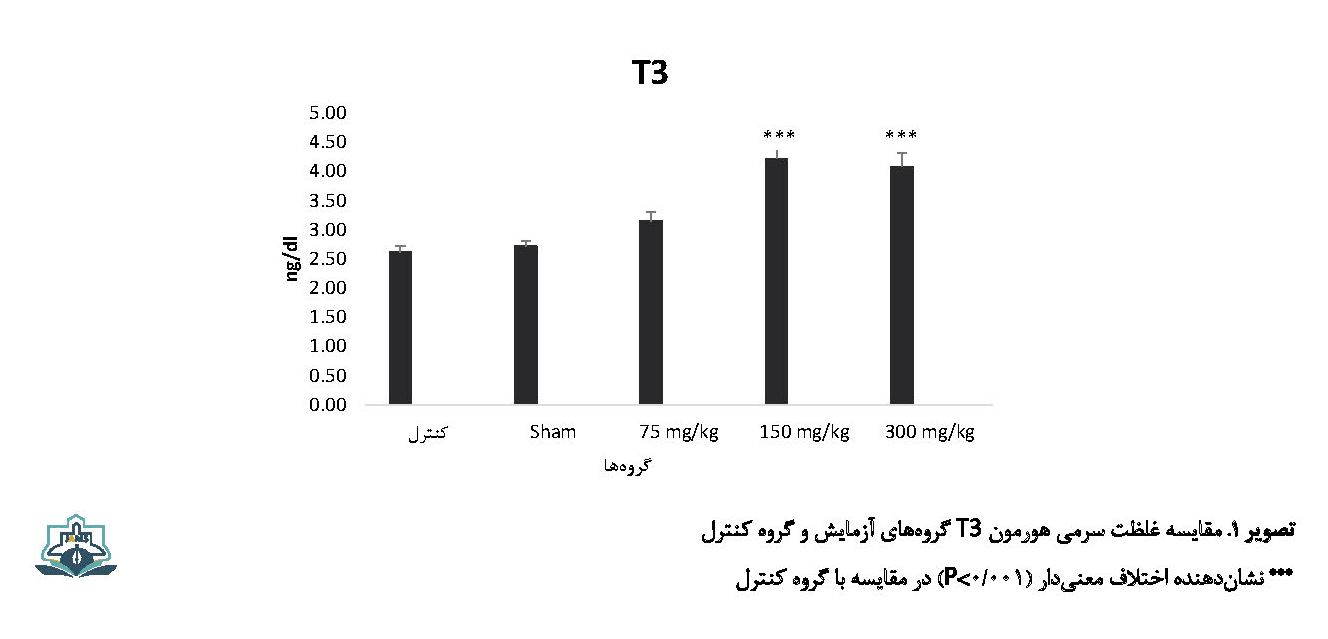
نتایج حاصل از تحلیل دادههای این مطالعه نشان داد که میانگین غلظت سرمی هورمون T3 برحسب واحد نانوگرم بر دسی لیتر در گروههای آزمایش 2 (mg/kg 150) و 3 (mg/kg 003) به ترتیب با مقادیر 0/17±4/22 و 0/23±4/08 افزایش معنیداری نسبت به گروه کنترل (0/11±2/62) داشته است (0/000=P) (تصویر شماره 1).
تیروئید یکی از غدد درونریز بدن و مسئول تنظیم اعمال مهمی است [1]. هورمونهای تیروئیدی در حفظ هموستاز انرژی، متابولیسم، تحریک فعالیت سلولها و همچنین در نمو، تمایز و بلوغ نقش ویژهای دارند. عقبماندگی ذهنی در کودکانی که کمبود هورمونهای تیروئیدی دارند، اهمیت این هورمون را مشخص میکند [2]. عدم ترشح تیروئید، باعث کاهش متابولیسم پایه به میزان 40 تا 50 درصد کمتر از حد طبیعی میشود و ترشح بیش از حد آن هم میتواند متابولیسم پایه را 60 تا 100 درصد بیشتر از حد طبیعی افزایش دهد. هورمون محرک تیروئید (TSH) که از غده هیپوفیز قدامی ترشح میشود کنترل ترشح تیروئید را برعهده دارد [3، 4]. بنابراین با توجه بروز عوارض مرتبط با افزایش و کاهش سطح سرمی هورمونهای تیروئید که میتوانند زندگی افراد را تهدید کنند، حفط هورمونها در سطح نرمال ضروری است. درمان هیپوتیروئیدی، به حد طبیعی رساندن سطح هورمونهای تیروئید در بافتهای محیطی است. در حال حاضر داروی لووتیروکسین در درمان هیپوتیروئیدیسم استفاده میشود [5].
امروزه استفاده از گیاهان دارویی در پیشگیری و درمان بیمار یها روند رو به رشدی دارد. در سا لهای گذشته و در برخی موارد داروهای طبیعی ب هخصوص گیاهان دارویی، تنها وسیله درمان محسوب م یشدند ] 7 ، 6[. در سه دهه گذشته استفاده از داروهای گیاهی و احیای طب سنتی در ایران نیز رواج پیدا کرده است ] 8[. مطالعات انجا مشده نشان م یدهد که ترکیبات فنولی، حاوی آنتیاکسیدانهای مؤثری در خنثیکردن رادیکالهای اکسیژندار هستند [9]. فلاونوئیدها با مهار فعالیت آنزیم دیدیناز نوع I و ممانعت از معدنیشدن ید در سلولهای تیروئید، هورمونهای تیروئید را تغییر میدهند [10، 11]. مطالعات گذشته نشان داده است که ترکیبات استروئیدی وکومارینی میتوانند بر هورمونهای محور هیپوفیز تیروئید تأثیرگذار باشند [12-14].
قارچ دنبلان شامل ترکیبات فلاونوئیدی، ترکیبات آنتیاکسیدان، ویتامینها، کارتنوئید و ترکیبات کومارینی و یونهای معدنی نظیر کلسیم، روی، آهن، مس و غیره است [15-17]. مطالعات قبلی نشان داده است که قارچ دنبلان بودیری در مبتلایان به دیابت باعث کاهش قند خون شده [18] و تأثیرات آنتیاکسیدانی و آنتیبیوتیکی در برابر میکروبها و انواع سرطانها دارد [15، 17]. با توجه به ترکیبات متنوع فلاونوئیدی، کومارینی و آنتیاکسیدانی موجود در این قارچ، تحقیق حاضر با هدف ارزیابی تأثیر عصاره هیدروالکلی قارچ دنبلان بر سطح هورمونهای تیروئیدی در موش صحرایی نر انجام شد.
مواد و روشها
موشهای صحرایی نر بالغ نژاد ویستار با وزن 200±10 گرم از حیوانخانه دانشگاه علومپزشکی اردبیل انتخاب شدند. حیوانات در دمای حدود 22±2 درجه سانتیگراد و با دوره نوری 12 ساعت روشنایی و 12 ساعت تاریکی نگهداری شدند. قبل از مطالعه و در طول مطالعه آب شهری در اختیار حیوانات قرار گرفت و رژیم غذایی نرمال برایشان اعمال شد.
در این مطالعه قارچ دنبلان از شهرستان پارسآباد استان اردبیل جمعآوری شد. قارچ بعد از خشکشدن با دستگاه آسیاب برقی پودر شد. یک لیتر آب و اتانول (نسبت 3 به 7) به هر 100 گرم پودر قارچ دنبلان افزوده شد تا در مدت 48 ساعت خیس شود و هر 6 ساعت به مدت 20 دقیقه روی شیکر قرار گرفت. بعد از عبوردادن عصاره از صافی واتمن، آب و الکل آن تبخیر شد. سپس عصاره خشکشده برای تهیه غلظتهای مختلف با سرم فیزیولوژی (حلال عصاره) مخلوط شد.
30 سر موش صحرایی نر مورد آزمایش در این مطالعه، به پنج گروه ششتایی تقسیم شدند. گروه کنترل، هیچچیز دریافت نکردند. گروه شم (سرم فیزیولوژی) و گروههای آزمایش 3 ،2 ،1 به ترتیب دریافتکننده دزهای 75، 150 و 300 mg/kg عصاره هیدروالکلی قارچ دنبلان بودند. عصاره به صورت داخل صفاقی و به مدت 14 روز تجویز شد.
24 ساعت پس از آخرین روز تجویز عصاره، حیوانات با ترازوی دیجیتال وزنکشی شده و سپس با کتامین ( 100 mg/kg) و زایلازین (01 mg/kg) تهیه شده از شرکت Alfasan هلند بیهوش شدند. سپس پوست ناحیه قفسه سینه، جناغ و دنده برش داده شد و خونگیری به صورت مستقیم از بطن چپ قلب انجام گرفت. جهت به دست آوردن سرم، نمونههای خونی پنج دقیقه با دور 3500، سانتریفیوژ شدند و سرم تا انجام آزمایش در دمای منهای 20 درجه نگهداری شد. سنجش هورمونها با استفاده از کیت Mono Bind (ساخت کشور آمریکا) و طبق دستورالعمل شرکت سازنده آن اندازهگیری شد.
تحلیل آماری
نتایج به صورت میانگین±انحراف معیار گزارش شد. دادهها با استفاده از نسخه 21 نرمافزار SPSS و از طریق آزمون آماری ANOVA یکطرفه و تست تعقیبی توکی در سطح معنیداری P<0/05 مورد تحلیل آماری قرار گرفتند.
یافتهها
نتایج حاصل از تحلیل دادههای این مطالعه نشان داد که میانگین غلظت سرمی هورمون T3 برحسب واحد نانوگرم بر دسی لیتر در گروههای آزمایش 2 (mg/kg 150) و 3 (mg/kg 003) به ترتیب با مقادیر 0/17±4/22 و 0/23±4/08 افزایش معنیداری نسبت به گروه کنترل (0/11±2/62) داشته است (0/000=P) (تصویر شماره 1).
همچنین نتایج حاصل از این مطالعه نشان داد که میانگین غلظت سرمی هورمون T4 برحسب µg/dl در گروههای آزمایش 2 (mg/kg 150) و 3 (mg/kg 003) به ترتیب با مقادیر 0/19±6/92 و 0/30±6/83 افزایش معنیداری نسبت به گروه کنترل (0/13±5/72) داشته است (0/004=P) و (0/008=P) (تصویر شماره 2).
نتایج این مطالعه نشان داد که میانگین غلظت سرمی هورمون TSH برحسب µIU/dl در گروههای آزمایش 1 (mg/kg 75)، 2 (mg/kg 150) و 3 (mg/kg 300) به ترتیب با مقادیر 0/02±0/42، 0/02±0/35 و 0/01±0/39 کاهش معنیداری نسبت به گروه کنترل (0/01±0/49) داشته است (0/034=P)، (0/000=P) و (0/001=P) (تصویر شماره 3).
بر اساس نتایج بهدستآمده، در مقایسه گروههای آزمایش دریافتکننده دزهای مختلف عصاره هیدروالکلی قارچ دنبلان، هیچ اختلاف معنیداری در وزن بدن مشاهده نشد (تصویر شماره 4).
نتایج این مطالعه نشان داد که میانگین غلظت سرمی هورمون TSH برحسب µIU/dl در گروههای آزمایش 1 (mg/kg 75)، 2 (mg/kg 150) و 3 (mg/kg 300) به ترتیب با مقادیر 0/02±0/42، 0/02±0/35 و 0/01±0/39 کاهش معنیداری نسبت به گروه کنترل (0/01±0/49) داشته است (0/034=P)، (0/000=P) و (0/001=P) (تصویر شماره 3).
بر اساس نتایج بهدستآمده، در مقایسه گروههای آزمایش دریافتکننده دزهای مختلف عصاره هیدروالکلی قارچ دنبلان، هیچ اختلاف معنیداری در وزن بدن مشاهده نشد (تصویر شماره 4).
در مقایسه گروه کنترل و شم، اختلاف معنیداری مشاهده نشد. در طول تحقیق 14روزه با دزهای mg/kg 300 و 150 ،75 سمیتی از قارچ دنبلان کوهی (افتادگی سر، ریزش مو، سیخشدن مو، لرزش، تعریق، اسهال و کاهش وزن) بر روی موشهای صحرایی مشاهده نشد.
بحث
مطالعه حاضر نشان داد که عصاره هیدروالکلی قارچ دنبلان توانست بدون تغییر در وزن موش صحرایی، سطح سرمی هورمونهای تیروئیدی را افزایش و میزان TSH را کاهش دهد. مطالعات قبلی بیانگر آن است که فلاونوئیدها با ممانعت از فعالیت آنزیم تیروپراکسیداز (TPO) بر عملکرد تیروئید تأثیر گذاشته و باعث کاهش سطح هورمونهای تیروئیدی میشوند [10، 13]. همچنین مطالعات گذشته نشان داده است که مشتقات کومارینی و آنتیاکسیدانها باعث افزایش سطح هورمونهای تیروئیدی میشوند [19، 20].
قارچ دنبلان حاوی ترکیباتی است که میتواند اثرات متناقضی بر روی تیروئید داشته باشد. نتایج این تحقیق نشان داد که سطح سرمی هورمونهای تیروئیدی احتمالاً تحت تأثیر ترکیبات کومارینی و آنتیاکسیدانی افزایش مییابد.
تحقیقات انجامشده روی نقش آنتیاکسیدان بر روی هورمونهای تیروئیدی نشان داد که رژیم غذایی با آنتیاکسیدانهای طبیعی ویتامین E و C میزان سرمی T4 و T3 را با تأثیرمستقیم آنتیاکسیدانها برروی غده تیروئید و یا فعالیت آنزیم دیدیناز افزایش میدهد [19]. همچنین در مطالعات مشابهی اثبات شده است که آنتیاکسیدانها، ویتامین C و E اثر مثبت بر غده تیروئید دارند و عصارههایی با ترکیبات فوق توانسته است کاهش القایی سطح هورمونهای تیروئید در موش را جبران کند [21].
از طرف دیگر، مطالعه آشتیانی چنگیزی و همکارانش نشان داد که گیاهانی که حاوی مقادیر زیادی اسیدهای چرب امگا 3، آلفالینوئیک اسید و انواع اسیدهای آمینه، ویتامینها و کاروتنوئیدهاست [22] میتواند غلظت هورمونهای تیروئیدی را افزایش و میزان TSH را کاهش دهد [23-22].
در خصوص علت افزایش غلظت هورمونهای تیروئیدی در گروههای دریافتکننده عصاره هیدروالکی قارچ دنبلان در مطالعه حاضر، احتمالاً قارچ دنبلان با داشتن ترکیبات مشابه و تنوع گستردهای از مواد مؤثره آنتیاکسیدان [17] قادر است با تحریک غده تیروئید باعث افزایش هورمونهای تیروئید شود که نشان میدهد یافتههای ما با مطالعات گذشته مطابقت دارد.
از طرفی کلسیم برای اکسیداسیون I- به I2 ضروری است [23] و عمل اکسیداسیون ید در غده تیروئید با استفاده از پراکسید هیدروژن ((H2O2 به عنوان سوبسترای اکسیدکننده انجام میشود؛ به طوری که در صورت کاهش کلسیم تولید H2O2 دچار اختلال میشود [24].
با توجه به اینکه قارچ دنبلان حاوی مواد معدنی کلسیم، روی، آهن و غیره [17] است، بنابراین احتمال دارد قارچ دنبلان با افزایش غلظت کلسیم و تبدیل I- به I2 و درنهایت تولید H2O2 بیشتر، سطح هورمونهای تیروئیدی را افزایش داده است.
یکی دیگر از نتایج این پژوهش کاهش سطح سرمی TSH بود. مطالعات انجامشده نشان داده است که اسید فرولیک با بالابردن سطح انسولین [25، 26] و همچنین IGF-1، قند خون را کاهش میدهد. با توجه به اینکه ترشح سوماتواستاتین هم تحت تأثیر فاکتور رشد شبهانسولین نوع اول (IGF-I) افزایش مییابد و اثر مهاری بر ترشح هورمونهای آزادکننده تیروتوروپین (TRH) دارد [27] و به دلیل اینکه فرولیک اسید یکی از ترکیبات فعال موجود در دنبلان است [15]، احتمال دارد دنبلان با همین مکانیسم میزان TSH را کاهش داده باشد.
از طرف دیگر ساخت و ترشح هورمونهای تیروئیدی توسط محور هورمونی هیپوتالاموس هیپوفیز کنترل میشود. هورمون آزادکننده تیروتروپین (TRH) از هسته پارا ونتریکولار هیپوتالاموس آزاد شده و با تأثیر بر روی هیپوفیز قدامی باعث ترشح هورمون TSH میشود و درنهایت TSH، ترشح هورمونهای T3 و T4 را تحت تأثیر خود قرار میدهد. کاهش میزان TSH، احتمالاً با مکانیسم بازخورد منفی موجود در محور هیپوتالاموسی هیپوفیزی تیروئیدی به دنبال افزایش غلظت سرمی هورمونهای تیروئیدی است [4]؛ بنابراین کاهش هورمون TSH ناشی از افزایش هورمونهای تیروئیدی در مطالعه حاضر قابل انتظار است.
این مطالعه نشان داد که عصاره هیدروالکلی قارچ دنبلان نتوانست وزن موشهای صحرایی مورد آزمایش را به صورت معنیدار افزایش دهد. مطالعات قبلی بیانگر آن است که فیتواسترولها باعث افزایش دی هیدرو اپی آندرسترون (DHEA) میشوند که این ترکیب باعث افزایش سوخت چربیها و کاهش ذخیره آنها در بافت میشود که به موجب آن جذب چربیها مهار شده و از این طریق باعث کاهش وزن بدن میشود. از طرف دیگر DHEA باعث تحریک تولید پروتئینهای ماهیچهای میشود که اثر کاهش وزن بدن را تا حدودی بهبود میبخشد [28]. از آنجایی که پژوهشهای گذشته نشان داده است وزن بدن و بیضهها تحت تأثیر هورمون تستسترون قرار دارد [29] و از طرفی ثابت شده است که قارچ دنبلان باعث افزایش تستسترون میشود [30]؛ بنابراین احتمال دارد عصاره دنبلان با همین مکانیسم باعث افزایش وزن موش شده است، ولی به دلیل کوتاهبودن دوره آزمایش، این افزایش معنیدار نبوده است.
نتیجهگیری
نتایج تحقیق حاضر نشان داد که عصاره هیدروالکلی قارچ دنبلان با تأثیر بر عملکرد غده تیروئید باعث افزایش هورمونهای تیروئیدی در موشهای صحرایی شده است. افزایش سطح سرمی هورمونهای تیروئید، احتمالاً به خاطر وجود مواد مؤثر، از جمله ترکیبات مشابه امگا 3، آنتیاکسیدانتها و مواد معدنی در قارچ دنبلان است. کاهش سطح سرمی TSH، ممکن است به علت فیدبک منفی هورمونهای تیروئید باشد. با توجه به نتایج این تحقیق، احتمالاً میتوان از این قارچ برای افزایش سطح هورمون T3 و T4 استفاده کرد. دستیافتن به چگونگی مکانیسم این اثرات و توصیه به استفاده از قارچ برای افزایش سطح هورمون تیروئیدی، نیازمند مطالعات بیشتر روی غده تیروئید و عوامل سلولی و مولکولی آن است. پیشنهاد میشود تأثیر این قارچ بر روی بافت غده تیروئید در مطالعات بعدی بررسی شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش در کمیته اخلاقی دانشگاه علومپزشکی اردبیل با کد IR-ARUMS-REC-1396-48 تصویب شده است.
حامی مالی
معاونت پژوهشی دانشگاه علومپزشکی از این مقاله حمایت مالی کرده است.
مشارکت نویسندگان
تمامی نویسندگان در نگارش مقاله به یک اندازه سهیم بودهاند.
تعارض منافع
تمامی نویسندگان اعلام میدارند که هیچگونه تضاد منافعی در خصوص این مطالعه وجود ندارد.
تشکر و قدردانی
این طرح در دانشگاه علومپزشکی اردبیل با کد شناسایی 9604 به تصویب رسیده است، بدینوسیله نویسندگان مقاله از معاونت پژوهشی دانشگاه علومپزشکی و خانم دکتر سعادتی به خاطر راهنمایی ارزندهشان تشکر و قدردانی میکنند.
References
Ahmadi R, Abbasi Z. Effect of aqueous extract aloe vera on serum levels of t3, t4 and tsh in male rats. J Med Plants. 2012; 4(44):149-54.
Patricia E. Endocrine physiology. 2nd edition. New York: McGrow Hill; 2007.
Hossini E, Sadeghi H, Daneshi A. Evaluation of hydro-alcoholic extract of peganum harmala on pituitary-thyroid hormones in adult male rats. Armaghane Danesh. 2010; 14(4):23-30.
Shekar Forosh S, Changizi-AshtiyaniS APB, Attari M. The effect of physalis alkekengi alcoholic extract on thyroid hormones concentrations in rats. Zahedan J Res Med Sci. 2012; 13:1-7.
Mistry D, Atkin S, Atkinson H, Gunasekaran S, Sylvester D, Rigby AS, et al. Predicting thyroxine requirements following total thyroidectomy. Clin Endocrinol. 2011; 74(3):384-7. [DOI:10.1111/j.1365-2265.2010.03940.x] [PMID]
May BH. Chinese herbal medicine for dementia & related disorders: An evaluation of traditional and scientific evidence [PhD dissertation]. Melbourne: RMIT University; 2009.
Zarei A, Ashtiyani S, Mohamadi AA, Gabari A. The effects of Physalis Alkekengi extract on lipids concentrations in rats. Arak Med Univ J. 2011; 14(2):36-42.
Modaresi M, Tavanaei F. The effect of hydroalcoholic extract of lettuce (lactuca sativa) on spermatogenesis and sexual hormones in male mice. J Adv Med Biomed Res. 2013; 21(87):32-41.
Katalinic V, MIlos M, Kulisic T, Jukic M. Sceerning of 70 medical plant extracts for antioxidant capacity and total phenols. Food Chem. 2006; 94: 550-77. [DOI:10.1016/j.foodchem.2004.12.004]
Robbins J, Rall J. Proteins associated with the thyroid hormones. Physiol Rev. 1960; 40:415-89. [DOI:10.1152/physrev.1960.40.3.415] [PMID]
Van Der Heide D, Kastelijn J, Schröder-van der Elst JP. Flavonoids and thyroid disease. Biofactors. 2003; 19(3, 4):113-9. [DOI:10.1002/biof.5520190303] [PMID]
Cooper DS, Klibanski A, Ridgway EC. Dopaminergic modulation of TSH and its subunits: In vivo and in vitro studies. Clin Endocrinol. 1983; 18(3):265-75. [DOI:10.1111/j.1365-2265.1983.tb03211.x] [PMID]
Ferreira AC, Neto JC, da Silva AC, Kuster RM, Carvalho DP. Inhibition of thyroid peroxidase by Myrcia uniflora flavonoids. Chem Res Toxicol. 2006; 19(3):351-5. [DOI:10.1021/tx0501684] [PMID]
Patton H, Fuchs AF. Text book of physiology. 21st edition. Philadelphia: Saunders; 1989.
Doðan H, Aydin S. Determination of antimicrobial effect, antioxidant activity and phenolic contents of desert truffle in Turkey. Afr J Tradit Complement Altern Med. 2013; 10(4):52-8. [DOI:10.4314/ajtcam.v10i4.9]
Dundar A, Yesil OF, Acay H, Okumus V, Ozdemir S, Yildiz A. Antioxidant properties, chemical composition and nutritional value of Terfezia boudieri (Chatin) from Turkey. Food Sci Technol Int. 2012; 18(4):317-28. [DOI:10.1177/1082013211427954] [PMID]
Hamza A, Zouari N, Zouari S, Jdir H, Zaidi S, Gtari M, et al. Nutraceutical potential, antioxidant and antibacterial activities of Terfezia boudieri Chatin, a wild edible desert truffle from Tunisia arid zone. Arab J Chem. 2016; 9(3):383-9. [DOI:10.1016/j.arabjc.2013.06.015]
Shakshak K, Afan A, Auzi A, Hamrouni A. The hypoglycemic effect of libyan truffle “TerfeziaBoudieri” in experimentally induced diabetic rats. Tripolitana Med J. 2014; 3(1):1-4.
Peepre K, Deshpandey U, Choudhary P. Role of antioxidants on thyroid hormones in Wister rats. Int J of Sci Res. 2014; 3(1):34-8.
Qin LP, Zhang HM, Zhang WD. [Effect of osthol and total coumarins of fructus cnidii on thyroid hormone and thyrotropic hormone in kidney-yang deficiency rats (Chinese)]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 1996; 16(9):552-3.
Petrulea MS, Duncea I, Hazi G, Dragotoiu G, Decea N, Mureşan A. Oxidative stress in experimental hypothyroidism: effect of vitamin E supplementation. Clujul Medical. 2010; 84:245-9.
Changizi Ashtiyani S, Zarei A, Taheri S, Ramazani M. Effect of alcoholic extract of Portulaca oleracea on serum level of thyroid hormones in hypercholestrolemic rats. J Gorgan Univ Med Sci. 2015; 17(2):52-58.
Dahham SS, Al-Rawi SS, Ibrahim AH, Majid AS, Majid AMSA. Antioxidant, anticancer, apoptosis properties and chemical composition of black truffle Terfezia claveryi. Saudi J Biol Sci. 2018; 25(8):1524-34. [DOI:10.1016/j.sjbs.2016.01.031] [PMID] [PMCID]
Slama A, Neffati M, Boudabous A. Biochemical composition of desert truffle Terfezia boudieri Chatin. Int Symp on Med and Aromat Plants SIPAM2009. 2009. [DOI:10.17660/ActaHortic.2010.853.33]
Asgary S, Naderi GA, Sarraf-Zadegan N, Vakili R. The inhibitory effects of pure flavonoids on in vitro protein glycosylation. JJ Herb Pharmacother. 2002; 2(2):47-55. https://doi.org/10.1080/J157v02n02_05 [DOI:10.1300/J157v02n02_05] [PMID]
Nomura H. Acceleration of ferulic acid and related compounds on insulin secession. Research report of Wakayama industrial technology center; 2001.
Gavin L, Moeller M. Somatostatin inhibits rat hepatic T4-5’-deiodinase. The effect is independent of the associated hypoinsulinemia. J Clin Invest. 1983; 72(6):2020-30. [DOI:10.1172/JCI111167] [PMID] [PMCID]
Bouret SG, Draper SJ, Simerly RB. Trophic action of leptin on hypothalamic neurons that regulate feeding. Science. 2004; 304(5667):108-10. [DOI:10.1126/science.1095004] [PMID]
Jahromi VH, Parivar K, Forozanfar M. The effect of cinnamon extract on spermatogenesis hormonal axis of pituitary gonad in mice. Iran J Appl Anim Sci. 2011; 1(2):99-103.
Khojasteh SMB, Amiri L, Sheikhzadeh F. Effect of the alcoholic extract of Terfezia boudieri on reproductive hormones in male rats. Int J Pharm Bio Sci. 2013; 3(2):517-22.
Ahmadi R, Abbasi Z. Effect of aqueous extract aloe vera on serum levels of t3, t4 and tsh in male rats. J Med Plants. 2012; 4(44):149-54.
Patricia E. Endocrine physiology. 2nd edition. New York: McGrow Hill; 2007.
Hossini E, Sadeghi H, Daneshi A. Evaluation of hydro-alcoholic extract of peganum harmala on pituitary-thyroid hormones in adult male rats. Armaghane Danesh. 2010; 14(4):23-30.
Shekar Forosh S, Changizi-AshtiyaniS APB, Attari M. The effect of physalis alkekengi alcoholic extract on thyroid hormones concentrations in rats. Zahedan J Res Med Sci. 2012; 13:1-7.
Mistry D, Atkin S, Atkinson H, Gunasekaran S, Sylvester D, Rigby AS, et al. Predicting thyroxine requirements following total thyroidectomy. Clin Endocrinol. 2011; 74(3):384-7. [DOI:10.1111/j.1365-2265.2010.03940.x] [PMID]
May BH. Chinese herbal medicine for dementia & related disorders: An evaluation of traditional and scientific evidence [PhD dissertation]. Melbourne: RMIT University; 2009.
Zarei A, Ashtiyani S, Mohamadi AA, Gabari A. The effects of Physalis Alkekengi extract on lipids concentrations in rats. Arak Med Univ J. 2011; 14(2):36-42.
Modaresi M, Tavanaei F. The effect of hydroalcoholic extract of lettuce (lactuca sativa) on spermatogenesis and sexual hormones in male mice. J Adv Med Biomed Res. 2013; 21(87):32-41.
Katalinic V, MIlos M, Kulisic T, Jukic M. Sceerning of 70 medical plant extracts for antioxidant capacity and total phenols. Food Chem. 2006; 94: 550-77. [DOI:10.1016/j.foodchem.2004.12.004]
Robbins J, Rall J. Proteins associated with the thyroid hormones. Physiol Rev. 1960; 40:415-89. [DOI:10.1152/physrev.1960.40.3.415] [PMID]
Van Der Heide D, Kastelijn J, Schröder-van der Elst JP. Flavonoids and thyroid disease. Biofactors. 2003; 19(3, 4):113-9. [DOI:10.1002/biof.5520190303] [PMID]
Cooper DS, Klibanski A, Ridgway EC. Dopaminergic modulation of TSH and its subunits: In vivo and in vitro studies. Clin Endocrinol. 1983; 18(3):265-75. [DOI:10.1111/j.1365-2265.1983.tb03211.x] [PMID]
Ferreira AC, Neto JC, da Silva AC, Kuster RM, Carvalho DP. Inhibition of thyroid peroxidase by Myrcia uniflora flavonoids. Chem Res Toxicol. 2006; 19(3):351-5. [DOI:10.1021/tx0501684] [PMID]
Patton H, Fuchs AF. Text book of physiology. 21st edition. Philadelphia: Saunders; 1989.
Doðan H, Aydin S. Determination of antimicrobial effect, antioxidant activity and phenolic contents of desert truffle in Turkey. Afr J Tradit Complement Altern Med. 2013; 10(4):52-8. [DOI:10.4314/ajtcam.v10i4.9]
Dundar A, Yesil OF, Acay H, Okumus V, Ozdemir S, Yildiz A. Antioxidant properties, chemical composition and nutritional value of Terfezia boudieri (Chatin) from Turkey. Food Sci Technol Int. 2012; 18(4):317-28. [DOI:10.1177/1082013211427954] [PMID]
Hamza A, Zouari N, Zouari S, Jdir H, Zaidi S, Gtari M, et al. Nutraceutical potential, antioxidant and antibacterial activities of Terfezia boudieri Chatin, a wild edible desert truffle from Tunisia arid zone. Arab J Chem. 2016; 9(3):383-9. [DOI:10.1016/j.arabjc.2013.06.015]
Shakshak K, Afan A, Auzi A, Hamrouni A. The hypoglycemic effect of libyan truffle “TerfeziaBoudieri” in experimentally induced diabetic rats. Tripolitana Med J. 2014; 3(1):1-4.
Peepre K, Deshpandey U, Choudhary P. Role of antioxidants on thyroid hormones in Wister rats. Int J of Sci Res. 2014; 3(1):34-8.
Qin LP, Zhang HM, Zhang WD. [Effect of osthol and total coumarins of fructus cnidii on thyroid hormone and thyrotropic hormone in kidney-yang deficiency rats (Chinese)]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 1996; 16(9):552-3.
Petrulea MS, Duncea I, Hazi G, Dragotoiu G, Decea N, Mureşan A. Oxidative stress in experimental hypothyroidism: effect of vitamin E supplementation. Clujul Medical. 2010; 84:245-9.
Changizi Ashtiyani S, Zarei A, Taheri S, Ramazani M. Effect of alcoholic extract of Portulaca oleracea on serum level of thyroid hormones in hypercholestrolemic rats. J Gorgan Univ Med Sci. 2015; 17(2):52-58.
Dahham SS, Al-Rawi SS, Ibrahim AH, Majid AS, Majid AMSA. Antioxidant, anticancer, apoptosis properties and chemical composition of black truffle Terfezia claveryi. Saudi J Biol Sci. 2018; 25(8):1524-34. [DOI:10.1016/j.sjbs.2016.01.031] [PMID] [PMCID]
Slama A, Neffati M, Boudabous A. Biochemical composition of desert truffle Terfezia boudieri Chatin. Int Symp on Med and Aromat Plants SIPAM2009. 2009. [DOI:10.17660/ActaHortic.2010.853.33]
Asgary S, Naderi GA, Sarraf-Zadegan N, Vakili R. The inhibitory effects of pure flavonoids on in vitro protein glycosylation. JJ Herb Pharmacother. 2002; 2(2):47-55. https://doi.org/10.1080/J157v02n02_05 [DOI:10.1300/J157v02n02_05] [PMID]
Nomura H. Acceleration of ferulic acid and related compounds on insulin secession. Research report of Wakayama industrial technology center; 2001.
Gavin L, Moeller M. Somatostatin inhibits rat hepatic T4-5’-deiodinase. The effect is independent of the associated hypoinsulinemia. J Clin Invest. 1983; 72(6):2020-30. [DOI:10.1172/JCI111167] [PMID] [PMCID]
Bouret SG, Draper SJ, Simerly RB. Trophic action of leptin on hypothalamic neurons that regulate feeding. Science. 2004; 304(5667):108-10. [DOI:10.1126/science.1095004] [PMID]
Jahromi VH, Parivar K, Forozanfar M. The effect of cinnamon extract on spermatogenesis hormonal axis of pituitary gonad in mice. Iran J Appl Anim Sci. 2011; 1(2):99-103.
Khojasteh SMB, Amiri L, Sheikhzadeh F. Effect of the alcoholic extract of Terfezia boudieri on reproductive hormones in male rats. Int J Pharm Bio Sci. 2013; 3(2):517-22.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |