دوره 22، شماره 5 - ( آذر و دی 1398 )
جلد 22 شماره 5 صفحات 55-44 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Soleyman M R, Khalili M, Soleyman Meiguni A, Baazm M. Optimization of PET Expression Vector for Fusion of Recombinant Protein and Elastin-Like Polypeptide Biopolymer. J Arak Uni Med Sci 2019; 22 (5) :44-55
URL: http://jams.arakmu.ac.ir/article-1-6079-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6079-fa.html
سلیمان محمدرضا، خلیلی مصطفی، سلیمان میگونی علیرضا، باعزم مریم. بهینهسازی وکتور بیانی pET جهت فیوژنکردن پروتئین نوترکیب و بیوپلیمر پلیپپتید شبهالاستین. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (5) :44-55
1- گروه بیوتکنولوژی و میکروبیولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.
2- مرکز تحقیقات انتقال خون، موسسه عالی آموزشی و پژوهشی طب انتقال خون و پایگاه منطق های انتقال خون مرکزی، اراک، ایران.؛ مرکز انتقال خون، اراک، ایران.
3- گروه مدیریت، واحد یادگار امام، دانشگاه آزاد اسلامی، شهر ری، ایران.
4- گروه علوم تشریح، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات سلولی و مولکولی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران. ،dr.baazm@arakmu.ac.ir
2- مرکز تحقیقات انتقال خون، موسسه عالی آموزشی و پژوهشی طب انتقال خون و پایگاه منطق های انتقال خون مرکزی، اراک، ایران.؛ مرکز انتقال خون، اراک، ایران.
3- گروه مدیریت، واحد یادگار امام، دانشگاه آزاد اسلامی، شهر ری، ایران.
4- گروه علوم تشریح، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات سلولی و مولکولی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران. ،
متن کامل [PDF 4046 kb]
(2275 دریافت)
| چکیده (HTML) (3498 مشاهده)
سابکلونینگ ژن MOD و ساخت وکتور pET-MOD
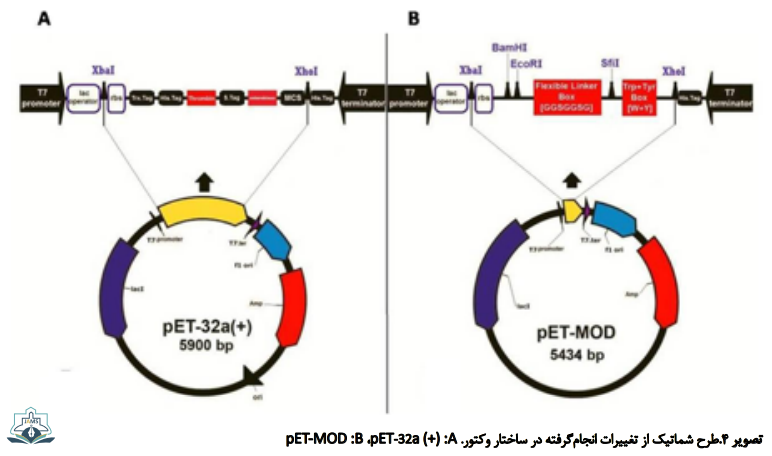
پس از هضم آنزیمی pUC-57 که حاوی قطعه ژن MOD است، با استفاده ازآنزیمهای محدودالاثر، قطعه bp 111 از ژن سنتزی MOD رها شده و با اتصال در محل توالیهای XbaI و XhoI، جایگزین توالی bp 577 از توالی pET-32a (+) شد. در این توالی نوکلئوتیدی بهینهشده، ژنهای بیانکننده توالیهای آمینواسیدی شامل Trx-Tag که با His-Tag (سایت شناسایی هضم آنزیمی پروتئاز ترومبین)، S-Tag (سایت شناسایی هضم آنزیمی پروتئاز TEV) و جایگاه کلونینگ چندگانه دنبال شده است، حذف شد. طول وکتور pET-32a (+) از طول bp 5900 به bp 5434 کاهش یافت (bp 466 کاهش طول). همچنین سایت شناسایی آنزیمهای محدودالاثر Sfi-I ،BamH-I و EcoR-I در توالی pET-MOD جایگزین شدند (تصویر شماره 3).
با برش توالیهای شناسایی BamH-I و EcoR-I، توالیهای چسبنده برای اتصال ژن پروتئین هدف با دم چسبنده مشابه ایجاد شد. پس از برش وکتور pET-MOD با Sfi-I، پلاسمید خطی با انتهای چسبنده سازگار با انتهای چسبنده ژن ELP (حاصل از الیگومریزهشدن با روش RDL) که توسط Bgl-I و pflM-I برش خورده بود، تولید شد. توالی نوکلئوتیدی کدکننده GGSGGSG (گلیسین + سیستئین) به عنوان ناحیه لینکر منعطف بین توالی پروتئین هدف و تگ ELP و توالی نوکلئوتیدی کدکننده WYWYW (تریپتوفان + تیروزین) در جهت برآورد غلظت پروتئین نوترکیب، به توالی MOD اضافه شد (تصویر شماره 4).
پلاسمید نوترکیبشده از سلول ترانسفرمشده تخلیص شد و تشکیل آن بر اساس اندازه پلاسمید مشخص شد (تصویر شماره 5). نهایتاً برای تأیید پلاسمید نوترکیب pET-MOD ،Colony-PCR انجام گرفت و حضور باند bp 160 روی ژل آگارز یک درصد و توالییابی ژن حاصل، صحت کلونینگ را نشان داد (تصویر شماره 6). توالی پلاسمید pET-MOD حاصل با کد KP834588/1 دردسترس است.
بحث
در این مطالعه، توالی bp 111 طراحی شد که حاوی جایگاه برش برای تولید فیوژن پروتئین نوترکیب در کنار تگ ELP بود و نیز شامل جایگاه برش مورد نیاز برای الیگومریزهکردن ELP، توالی نوکلئوتیدی کدکننده GGSGGSG (گلیسین + سیستئین) به عنوان ناحیه لینکر منعطف بین توالی پروتئین هدف و تگ ELP، توالی نوکلئوتیدی کدکننده WYWYW (تریپتوفان + تیروزین) در جهت برآورد غلظت پروتئین نوترکیب و سایر توالیهای لازم برای بیان و خالصسازی پروتئین بود. این توالی پس سنتز مابین جایگاه برش XbaI و XhoI در وکتور بیانی pET-32a (+) کلون شد. درنتیجه وکتور pET-MOD، با کاهش طول bp 466 و دارابودن توالیهای لازم برای تولید فیوژن پروتئین نوترکیبِ دارای دنباله تخلیصی ELP و توالی لازم برای الیگومریزهکردن ELP ساخته شد.
پلیپپتیدهای شبهالاستین دستهای از بیوپلیمرهای حساس به دما با کاربردهای بیوتکنولوژی و زیستپزشکی گوناگون هستند. ELP ویژگیهای منحصربهفردی دارد از جمله اینکه میتواند به صورت ژنتیکی کد شود و از این طریق فرصت کنترل بر توالی آمینواسید و وزن مولکولی را فراهم میکند. دمای تغییر (Tt) مولکول ELP تحت کنترل فاکتورهای خارجی و داخلی همانند طول مولکول ELP قرار دارد. بنابراین طراحی ELPها برای استفادههای ویژه امکانپذیر است. به علت تأثیرپذیری حرارتی مولکول ELP، خالصسازی به واسطه کروماتوگرافی برای تخلیص پروتئین نیاز نیست. از این گذشته، ELP زیستتخریبپذیر، زیستسازگار و غیرایمونولوژیک و غیرسمی است و میتواند به میزان زیادی بیان شود [20 ،19]. تولید مقدار فراوان پروتئین فیوژن زیستفعال، موضوع حیاتی در بیوتکنولوژی است و ELP فیوژن، انتخاب مناسبی برای این موضوع است. محل قرارگیری و جهتگیری ELP نسبت به پروتئین هدف، اثر مهمی بر فعالیت اختصاصی و میزان بیان پروتئین هدف دارد. هنگامی که ELP در C- ترمینال پروتئین هدف قرار گرفته باشد (Pro-ELP)، پروتئین هدف بیشتری در مقایسه با هنگامی که ELP در N- ترمینال پروتئین هدف قرار دارد (ELP-Pro) به دست میآید [21]. همچنین میزان تولید پروتئین ELPهای بلند کمتر از میزان انواع کوتاه آن است [22]. مشخص شده است که تگ ELP ممکن است بر اساس اندازه و جهت قرارگیری، همانند بسیاری از تگها، زیستفعالی پروتئین فیوژنشده را کاهش دهد [23].
در مطالعات مختلفی که در زمینه تولید فیوژن پروتئین نوترکیب و تگ ELP، صورت گرفته است، به منظور کنار هم قراردادن این ژنها در کنار هم محققان از روشهای مختلفی از جمله سنتز طول کامل ژن موردنظر استفاده کردند، که این امر علاوه هزینهبربودن، به خاطر طولانیبودن توالی زمانبر و دارایی پیچیدگی سنتز خواهد بود [24]. در روش دیگر از کلونسازی ابتدایی در وکتور غیربیانی و سپس سابکلونینگ استفاده شده است که این روش نیز زمانبر و نیز به علت غیراختصاصیبودن وکتورها، در الیگومریزهکردن پیچیدگی دارد [26 ،25].
در مطالعه انجامشده توسط عمومی و همکاران، برای ساخت کاست 8xELP-Intein-hEGF به صورت چندمرحلهای سه توالی مورد نظر در pUC57 کلون شد و پس از تکمیلشدن سازه در وکتور بیانی pET15b بیان شد [27] که با توجه به چندمرحلهای بودن بر پیچیدگی کار میافزاید، علاوه بر این توالی 8xELP در خارج از وکتور طراحی و سپس کلون شد. در حالی که در وکتور pET-MOD امکان الیگومریزهکردن و تنظیم طول موردنظر بر اساس نیاز ممکن است. همچنین با توجه سایت برش و توالیهای در نظر گرفته شده در وکتور طراحیشده، امکان استفاده از این وکتور همانند وکتور تجاری جهت کلونکردن انواع پروتئینهای نوترکیب در کنار تگ ELP، ممکن است.
گروه تحقیقاتی ما، در مطالعات قبلی از وکتور دستکاریشده به منظور الیگومریزهکردن ELP استفاده کردند [28]، ولی با توجه برخی از معایب، از جمله احتیاج به وجود اسیدآمینههای دارای زنجیره جانبی آروماتیک در ساختار پروتئین نوترکیب، به منظور محاسبه غلظت پروتئین به وسیله جذب نور UV و نیز نبود طراحی لینکر منعطف بین پروتئین نوترکیب و تگ ELP، احتمال اختلال در عملکرد پروتئین نوترکیب، بهویژه در صورتی که این پروتئین فاکتور رشد باشد، وجود داشت.
در این مطالعه برای اولینبار، با استفاده از وکتورهای pET و ژن سنتزی MOD، وکتور اختصاصی pET-MOD به منظور استفاده در تولید مقادیر بالای پروتئین فیوژن زیستفعال با قابلیت الیگومریزهکردن تگ ELP، طراحی و ساخته شد. طراحی ژن سنتتیک MOD بر اساس نیازهای زیر انجام گرفته است: 1. کاهش طول توالی وکتور pET-MOD از طریق حذف توالی غیرضرور موجود در وکتور پایه pET-32a (+)، به منظور کاهش بار اضافی بر سلول میزبان وکتور و در نتیجه افزایش تولید پروتئین فیوژن موردنظر در میزبان سلولی؛ 2. اضافهکردن توالی محل شناسایی Sfi-I که مکمل ژن insert حاصل از الیگومریزهشدن ژن ELP تولیدشده با تکنیک RDL است و پیچیدگی ناشی از الیگومریزهکردن ژن ELP را در وکتورهای غیراختصاصی کاهش خواهد داد؛ 3. الحاق توالی شناسایی BamHI و EcoRI به منظور الحاق توالی و ساخت پروتئین فیوژن با ELP؛ 4. الحاق جعبه توالی نوکلئوتیدی کدکننده لینکر انعطافپذیر بین تگ ELP و پروتئین هدف، به منظور کاهش تداخل فضایی بر فعالیت پروتئین نوترکیب، بهویژه در مورد تأثیر بر عملکرد فاکتورهای رشد فیوژنشده با تگ ELP 5. الحاق جعبه توالی نوکلئوتیدی کدکننده آمینواسیدها با زنجیره جانبی آروماتیک برای جذب نور UV پروتئین نوترکیب ( به منظور محاسبه غلظت پروتئین)، بهویژه در مورد پروتئینهای فاقد اسیدآمینههای آروماتیک [29].
علاوه بر این، pET-MOD دارای توالی 6XHis-Tag در انتهای C تگ ELP در ساختار بیانی منطبق با کدون پروتئین فیوژن است. این ساختار از شش آمینواسید هستیدین متوالی تشکیل شده است که امکان تخلیص پروتئین نوترکیب فیوژن با استفاده از رزینها را فراهم میکند. به علاوه، حضور تگ هیستیدینی امکان استفاده از آن را به عنوان اپیتوپ جهت تشخیص پروتئین با استفاده از آنتیبادی منوکلونال یا کونژوگه با آنزیم nitrilotriacetic acid-nickel فراهم میکند.6XHis-Tag به صورت نرمال بر ساختار و فعالیت پروتئین نوترکیب تأثیرگذار نیست [30].
با توجه به امکان pET-MOD در خالصسازی پروتئین نوترکیب با استفاده از روش ترکیبی تگ ELP و تگهای هیستیدین و درنتیجه خالصسازی پشت سرهم و کاملکننده همدیگر، امکان حضور آلودگی در محلول نهایی به صورت محسوسی کاهش خواهد یافت.
با توجه به ویژگیهای pET-MOD، استفاده از این وکتور جهت خالصسازی پروتئین نوترکیب و نیز تولید فیوژن پروتئین با تگELP، به منظور استفاده به عنوان داربست حاوی الاستین به عنوان بخشی از ماتریکس خارج سلولی از یک طرف و از طرف دیگر وجود فاکتورهای رشد بر اساس مطالعه موردنظر، جهت مطالعات مختلف از جمله ترمیم زخم پیشنهاد میشود.
نتیجهگیری
در این مطالعه، طراحی و ساخت پلاسمید pET-MOD (5/4 Kbp) با جایگزینی بخشی از توالیهای pET-32a (+) به منظور تولید وکتور مناسب، در جهت ملحقکردن ژن ELP و پروتئین هدف و تولید بیومتریال فعال در مطالعات آتی انجام گرفت.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه علومپزشکی اراک با کد 11-146-92 تصویب شد.
حامی مالی
این مقاله با حمایت مالی معاونت پژوهشی دانشگاه علوم پزشکی اراک انجام شده است.
مشارکت نویسندگان
محمدرضا سلیمان ومصطفی خلیلی: تحقیق و بررسی، نگارش پیشنویس؛ علیرضا سلیمان میگونی: نگارش پیشنویس، تحلیل؛ مریم باعزم: نظارت، مدیریت پروژه، ویراستاری و نهاییسازی نوشت.
تعارض منافع
نویسندگان تصریح میکنند هیچگونه تضاد منافعی در خصوص پژوهش حاضر نداشتند.
تشکر و قدردانی
نویسندگان کمال قدردانی و امتنان را از معاونت پژوهشی دانشگاه علوم پزشکی اراک دارند.
متن کامل: (4042 مشاهده)
مقدمه
بیوپلیمرهای طبیعی و مصنوعی دستهای از مواد هستند که به عنوان داربست مهندسی بافت، ماتریکس انتقال دارو و سنسور انتقالدهنده در بیوسنسورها استفاده میشوند. پپتیدها جزء دسته جدیدی از بیوپلیمرها هستند، که ویژگیهای شیمیایی، فیزیکی و فعالیتهای بیولوژیکی متنوع آن مورد توجه است. از این رو، پلیمرهای برگرفته از پروتئین به عنوان گروه جدیدی از مواد با پتانسیل بالا برای ساخت مواد زیستفعال در نظر گرفته میشوند [2 ،1]. برای ساخت پروتئین دو استراتژی کلی وجود دارد: سنتز شیمیایی و تولید نوترکیب پروتئین. در سنتز شیمیایی پروتئینها، افزایش میزان تولید و افزایش طول توالی آمینواسیدها بهراحتی امکانپذیر نیست؛ اما تکنیک DNA نوترکیب دقت بالقوهای برای تولید پلیپپتیدهای جدید با ویژگی موردنظر و اختصاصیت بالا و مرتبط با توالی آمینواسیدی و شیمی فضایی دارد. سیستم نوترکیب بهترین رویکرد برای کاهش هزینه تولید پپتیدهای بلند و پروتئین است [4 ،3].
توالیهای کوتاه از نوکلئوتیدها (تا طول 100 نوکئوتید) میتوانند توسط سنتز شیمیایی تولید و سپس برای کدکردن پلیپپتیدهای تکراری با وزن مولکولی موردنظر به صورت قطعههای بزرگتر به یکدیگر ملحق شوند [3]. در میان متدهای فراوان که به صورت متداول برای کنار هم قراردادن توالیهای کوچک DNA با جهتگیری صحیح به کار میرود، اتصال مستقیم بازگشتی به عنوان یک روش سریع و مفید جهت تولید بیوپلیمرهای الیگومریک با وزن مولکولی موردنظر مفید است [5]. اخیراً، پلیمرهای فراوانی جهت مصارف مهندسی بافت با استفاده از توالیهای الاستین انسانی به عنوان زیرواحدهای ساختاری این بیوپلیمرها به کار گرفته شدهاند که کنترل ویژگیهای پلیپپتیدی آن در سطح سنتز شیمیایی و ژنتیکی امکانپذیر است [6].
پلیپپتید شبهالاستین جزء بیوپلیمرهای مصنوعی حساس به دماست که از پنتاپپتیدهای تکراری n(VPGXG) تشکیل شدهاند،در این توالی X میتواند هر اسیدآمینهای به غیر از پرولین بوده و n عداد این تکرارها ست. حلّالیت پلیپپتید شبهالاستین به تغییر دما وابسته است؛ به طوری که در زیر دمای تغییر، ELP در محیط آبی محلول بوده و با افزایش دمای محلول به صورت خودآرایی تجمع مییابد [7]. هنگامی که در سطح ژن ELP به پروتئین هدف ملحق میگردد، مجموع پروتئینی حاصل نیز دارای همان تغییر فاز برگشتپذیر خواهد شد. اکنون، به فرایند عاملدارکردن پروتئینهای هدف با ملحقکردن ELP به N- ترمینال یا C- ترمینال پروتئینهای هدف در سطح ژن، ELPyation گفته میشود [9 ،8]. این تکنیک روشی غیرکروماتوگرافیکی و ارزانقیمت با صرفهجویی در زمان برای تخلیص پروتئین هدف است. در روش RDL، ژنهای مونومری سنتز شده ELP به صورت معمول در وکتور کلونینگی همانند سیستم وکتور pUC الیگومریزه میشوند که این سیستم وکتور جهت بیان مناسب نیست. بنابراین، محصول ژنی الیگومریزهشده نهایی باید در وکتور بیانی کلون شود [10 ،5].
در مطالعات مختلفی به منظور تخلیص غیرگروماتوگرافی و یا انتقال هدفمند، از پروتئین نوترکیب فیوژنشده به تگ ELP استفاده شده است. از جمله این موارد میتوان به تخلیص فاکتورهای رشد [12 ،11]، آنزیمها [14 ،13]، و انتقال هدفمند داروها [15]، اشاره کرد. با این حال، در این مطالعات به منظور تولید فیوژن پروتئین نوترکیب متصل به تگ ELP و نیز الیگومریزهکردن ELP احتیاج به چندین مرحله کلونینگ در وکتور غیراختصاصی و ساب کلونینگ مجدد است. بنابراین در این مطالعه، با بهینهسازی وکتور بیانی pET و وکتور اختصاصی pET- MOD، جهت الیگومریزهکردن ELP و نیز تولید فیوژن پروتئین نوترکیب متصل به تگ ELP، برای مصارف بیوتکنولوژی و دارویی مانند تخلیص ارزانقیمت پروتئین نوترکیب با تکنیک ITC و انتقال هدفمند، داروی کونژوگه و غیره تولید خواهد شد.
مواد و روشها
در این مطالعه بنیادیکاربردی، میزبان E.coli سویه a5HD Invitrogen)) و پلاسمید (+) 32a pET- (Novagen, USA) برای انجام کلونینگ استفاده شد. همچنین از آنزیمهای محدودالاثر SfII ،XbaI و XhoI و آنزیم آلکالن فسفاتاز ساخت شرکت Fermentas ،pfu DNA polymerase و T4 DNA Ligase ساخت شرکت Vivantis در این تحقیق استفاده شد.
طراحی و ارزیابی بیوانفورماتیک ژن MOD
ژن MOD شامل توالیهای نوکلئوتیدی شاین دلگارنو به عنوان کدون شروع ابتدایی، نواحی شناسایی آنزیمهای محدودالاثر، بعضی تگها و نواحی ارتباطی مورد نیاز برای کلونینگ، بیان و خالصسازی پروتئین نوترکیب طراحی شد. سپس، سایتهای برش آنزیمهای محدودالاثر XbaI و XhoI به ترتیب در انتهای 5' و 3' اضافه شدند. پیشبینی ساختارهای دوم و پایداری mRNA بیانشونده در pET-32a (+) و pET-MOD توسط سرور center fold ارزیابی شد. علاوه بر این، محتوای G+C این دو قطعه توسط Rare Codon Analysis Tools ارزیابی شد. ژن طراحیشده توسط شرکت بیوماتیک (Biomatik, Canada) سنتز شد.
سابکلونینگ ژن MOD در وکتور بیانی pET-32a (+)
اصول مهندسی ژنتیک بر اساس اصول سمبروک و همکاران به کار گرفته شده است [16]. pUC-57 حملکننده ژن طراحیشده سنتزی MOD توسط شرکت بیوماتیک (Biomatik, Canada)، توسط آنزیمهای XbaI و lohX (Fermentas-Lithuania) برش خورده تا قطعه MOD سنتزی آزاد شود. وکتور pET-32a (+) نیز توسط آنزیمهای XbaI و XhoI برش خورده و توسط آنزیم آلکالن فسفاتاز دفسفریله شد تا پلاسمید خطی شود. خالصسازی پلاسمید خطیشده و DNA برشخورده MOD توسط کیت تخلیص از ژل آگارز (Roche-Germany) انجام گرفت. وکتورpET و قطعه الحاقی MOD برشخورده (با نسبت 1 به 3 قطعه به وکتور) توسط esagil AND 4T (Fermentas-Lithuania) به هم ملحق شدند تا وکتور pET-MOD حاصل شود.
وکتورهای حاصل از طریق روش شوک حرارتی (39 درجه به مدت یک دقیقه) به 100 میکرولیتر از سلولهای (E.coli-BL21 (DE3 مستعد شده با استفاده از CaCl2 ترانسفرم شدند و سپس باکتریها در پلیت کشت سلولی حاوی محیط کشت Luria-Bertani و100 میکروگرم / میلیلیتر آمپیسیلین گسترده شده و در 37 درجه سانتیگراد به صورت شبانه انکوبه شدند. پس از ترانسفرماسیون، کلنیهای نوترکیب بر اساس اندازه پلاسمید جداسازی شده [17] و کلنیهای مثبت به منظور بررسی حضور قطعه insert با استفاده از آنالیز برش با آنزیمهای محدودالاثر بررسی شدند. تأیید نهایی کلنیهای نوترکیب از طریق تکنیک کلنی PCR با استفاده از پرایمرهای 5'TCAGTGGTGGTGGTGGTG-3' و 5'-GGGAATTGTGAGCGGATAAC-3' که برای این مطالعه طراحی شده بود انجام شد و محصول PCR با ژل آگارز یک درصد و توالییابی AND(DNA sequencing) تأیید شد.
یافتهها
طراحی و ارزیابی بیوانفورماتیک وکتور pET-MOD
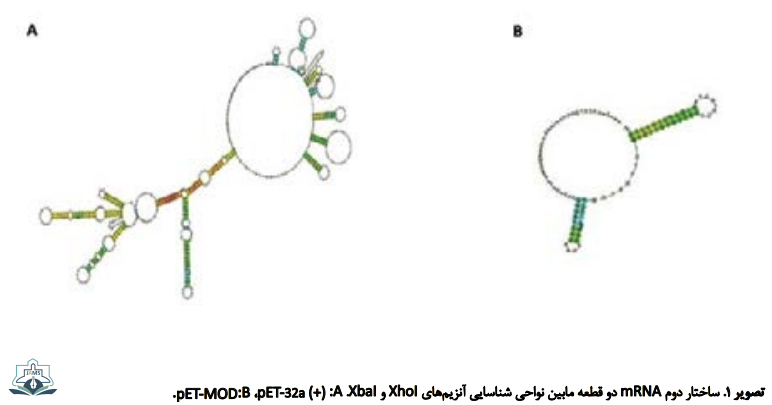
پیشبینی ساختار دوم mRNA نشان داد بهینهسازی وکتور بیانی pET میتواند از تشکیل ساختار دوم پایدار جلوگیری کند (تصویر شماره 1)، به صورتی که ساختار ساده و سست mRNA برای ترجمه مناسب باشد [18]. انرژی آزاد ساختار دوم mRNA نیز از 8/122- به 20- تغییر پیدا کرد. درصد محتوای G+C این دو ژن نیز مشابه و در محدوده ایدهآل (50-51 درصد) قرار داشت (تصویر شماره 2).
بیوپلیمرهای طبیعی و مصنوعی دستهای از مواد هستند که به عنوان داربست مهندسی بافت، ماتریکس انتقال دارو و سنسور انتقالدهنده در بیوسنسورها استفاده میشوند. پپتیدها جزء دسته جدیدی از بیوپلیمرها هستند، که ویژگیهای شیمیایی، فیزیکی و فعالیتهای بیولوژیکی متنوع آن مورد توجه است. از این رو، پلیمرهای برگرفته از پروتئین به عنوان گروه جدیدی از مواد با پتانسیل بالا برای ساخت مواد زیستفعال در نظر گرفته میشوند [2 ،1]. برای ساخت پروتئین دو استراتژی کلی وجود دارد: سنتز شیمیایی و تولید نوترکیب پروتئین. در سنتز شیمیایی پروتئینها، افزایش میزان تولید و افزایش طول توالی آمینواسیدها بهراحتی امکانپذیر نیست؛ اما تکنیک DNA نوترکیب دقت بالقوهای برای تولید پلیپپتیدهای جدید با ویژگی موردنظر و اختصاصیت بالا و مرتبط با توالی آمینواسیدی و شیمی فضایی دارد. سیستم نوترکیب بهترین رویکرد برای کاهش هزینه تولید پپتیدهای بلند و پروتئین است [4 ،3].
توالیهای کوتاه از نوکلئوتیدها (تا طول 100 نوکئوتید) میتوانند توسط سنتز شیمیایی تولید و سپس برای کدکردن پلیپپتیدهای تکراری با وزن مولکولی موردنظر به صورت قطعههای بزرگتر به یکدیگر ملحق شوند [3]. در میان متدهای فراوان که به صورت متداول برای کنار هم قراردادن توالیهای کوچک DNA با جهتگیری صحیح به کار میرود، اتصال مستقیم بازگشتی به عنوان یک روش سریع و مفید جهت تولید بیوپلیمرهای الیگومریک با وزن مولکولی موردنظر مفید است [5]. اخیراً، پلیمرهای فراوانی جهت مصارف مهندسی بافت با استفاده از توالیهای الاستین انسانی به عنوان زیرواحدهای ساختاری این بیوپلیمرها به کار گرفته شدهاند که کنترل ویژگیهای پلیپپتیدی آن در سطح سنتز شیمیایی و ژنتیکی امکانپذیر است [6].
پلیپپتید شبهالاستین جزء بیوپلیمرهای مصنوعی حساس به دماست که از پنتاپپتیدهای تکراری n(VPGXG) تشکیل شدهاند،در این توالی X میتواند هر اسیدآمینهای به غیر از پرولین بوده و n عداد این تکرارها ست. حلّالیت پلیپپتید شبهالاستین به تغییر دما وابسته است؛ به طوری که در زیر دمای تغییر، ELP در محیط آبی محلول بوده و با افزایش دمای محلول به صورت خودآرایی تجمع مییابد [7]. هنگامی که در سطح ژن ELP به پروتئین هدف ملحق میگردد، مجموع پروتئینی حاصل نیز دارای همان تغییر فاز برگشتپذیر خواهد شد. اکنون، به فرایند عاملدارکردن پروتئینهای هدف با ملحقکردن ELP به N- ترمینال یا C- ترمینال پروتئینهای هدف در سطح ژن، ELPyation گفته میشود [9 ،8]. این تکنیک روشی غیرکروماتوگرافیکی و ارزانقیمت با صرفهجویی در زمان برای تخلیص پروتئین هدف است. در روش RDL، ژنهای مونومری سنتز شده ELP به صورت معمول در وکتور کلونینگی همانند سیستم وکتور pUC الیگومریزه میشوند که این سیستم وکتور جهت بیان مناسب نیست. بنابراین، محصول ژنی الیگومریزهشده نهایی باید در وکتور بیانی کلون شود [10 ،5].
در مطالعات مختلفی به منظور تخلیص غیرگروماتوگرافی و یا انتقال هدفمند، از پروتئین نوترکیب فیوژنشده به تگ ELP استفاده شده است. از جمله این موارد میتوان به تخلیص فاکتورهای رشد [12 ،11]، آنزیمها [14 ،13]، و انتقال هدفمند داروها [15]، اشاره کرد. با این حال، در این مطالعات به منظور تولید فیوژن پروتئین نوترکیب متصل به تگ ELP و نیز الیگومریزهکردن ELP احتیاج به چندین مرحله کلونینگ در وکتور غیراختصاصی و ساب کلونینگ مجدد است. بنابراین در این مطالعه، با بهینهسازی وکتور بیانی pET و وکتور اختصاصی pET- MOD، جهت الیگومریزهکردن ELP و نیز تولید فیوژن پروتئین نوترکیب متصل به تگ ELP، برای مصارف بیوتکنولوژی و دارویی مانند تخلیص ارزانقیمت پروتئین نوترکیب با تکنیک ITC و انتقال هدفمند، داروی کونژوگه و غیره تولید خواهد شد.
مواد و روشها
در این مطالعه بنیادیکاربردی، میزبان E.coli سویه a5HD Invitrogen)) و پلاسمید (+) 32a pET- (Novagen, USA) برای انجام کلونینگ استفاده شد. همچنین از آنزیمهای محدودالاثر SfII ،XbaI و XhoI و آنزیم آلکالن فسفاتاز ساخت شرکت Fermentas ،pfu DNA polymerase و T4 DNA Ligase ساخت شرکت Vivantis در این تحقیق استفاده شد.
طراحی و ارزیابی بیوانفورماتیک ژن MOD
ژن MOD شامل توالیهای نوکلئوتیدی شاین دلگارنو به عنوان کدون شروع ابتدایی، نواحی شناسایی آنزیمهای محدودالاثر، بعضی تگها و نواحی ارتباطی مورد نیاز برای کلونینگ، بیان و خالصسازی پروتئین نوترکیب طراحی شد. سپس، سایتهای برش آنزیمهای محدودالاثر XbaI و XhoI به ترتیب در انتهای 5' و 3' اضافه شدند. پیشبینی ساختارهای دوم و پایداری mRNA بیانشونده در pET-32a (+) و pET-MOD توسط سرور center fold ارزیابی شد. علاوه بر این، محتوای G+C این دو قطعه توسط Rare Codon Analysis Tools ارزیابی شد. ژن طراحیشده توسط شرکت بیوماتیک (Biomatik, Canada) سنتز شد.
سابکلونینگ ژن MOD در وکتور بیانی pET-32a (+)
اصول مهندسی ژنتیک بر اساس اصول سمبروک و همکاران به کار گرفته شده است [16]. pUC-57 حملکننده ژن طراحیشده سنتزی MOD توسط شرکت بیوماتیک (Biomatik, Canada)، توسط آنزیمهای XbaI و lohX (Fermentas-Lithuania) برش خورده تا قطعه MOD سنتزی آزاد شود. وکتور pET-32a (+) نیز توسط آنزیمهای XbaI و XhoI برش خورده و توسط آنزیم آلکالن فسفاتاز دفسفریله شد تا پلاسمید خطی شود. خالصسازی پلاسمید خطیشده و DNA برشخورده MOD توسط کیت تخلیص از ژل آگارز (Roche-Germany) انجام گرفت. وکتورpET و قطعه الحاقی MOD برشخورده (با نسبت 1 به 3 قطعه به وکتور) توسط esagil AND 4T (Fermentas-Lithuania) به هم ملحق شدند تا وکتور pET-MOD حاصل شود.
وکتورهای حاصل از طریق روش شوک حرارتی (39 درجه به مدت یک دقیقه) به 100 میکرولیتر از سلولهای (E.coli-BL21 (DE3 مستعد شده با استفاده از CaCl2 ترانسفرم شدند و سپس باکتریها در پلیت کشت سلولی حاوی محیط کشت Luria-Bertani و100 میکروگرم / میلیلیتر آمپیسیلین گسترده شده و در 37 درجه سانتیگراد به صورت شبانه انکوبه شدند. پس از ترانسفرماسیون، کلنیهای نوترکیب بر اساس اندازه پلاسمید جداسازی شده [17] و کلنیهای مثبت به منظور بررسی حضور قطعه insert با استفاده از آنالیز برش با آنزیمهای محدودالاثر بررسی شدند. تأیید نهایی کلنیهای نوترکیب از طریق تکنیک کلنی PCR با استفاده از پرایمرهای 5'TCAGTGGTGGTGGTGGTG-3' و 5'-GGGAATTGTGAGCGGATAAC-3' که برای این مطالعه طراحی شده بود انجام شد و محصول PCR با ژل آگارز یک درصد و توالییابی AND(DNA sequencing) تأیید شد.
یافتهها
طراحی و ارزیابی بیوانفورماتیک وکتور pET-MOD
پیشبینی ساختار دوم mRNA نشان داد بهینهسازی وکتور بیانی pET میتواند از تشکیل ساختار دوم پایدار جلوگیری کند (تصویر شماره 1)، به صورتی که ساختار ساده و سست mRNA برای ترجمه مناسب باشد [18]. انرژی آزاد ساختار دوم mRNA نیز از 8/122- به 20- تغییر پیدا کرد. درصد محتوای G+C این دو ژن نیز مشابه و در محدوده ایدهآل (50-51 درصد) قرار داشت (تصویر شماره 2).
سابکلونینگ ژن MOD و ساخت وکتور pET-MOD
پس از هضم آنزیمی pUC-57 که حاوی قطعه ژن MOD است، با استفاده ازآنزیمهای محدودالاثر، قطعه bp 111 از ژن سنتزی MOD رها شده و با اتصال در محل توالیهای XbaI و XhoI، جایگزین توالی bp 577 از توالی pET-32a (+) شد. در این توالی نوکلئوتیدی بهینهشده، ژنهای بیانکننده توالیهای آمینواسیدی شامل Trx-Tag که با His-Tag (سایت شناسایی هضم آنزیمی پروتئاز ترومبین)، S-Tag (سایت شناسایی هضم آنزیمی پروتئاز TEV) و جایگاه کلونینگ چندگانه دنبال شده است، حذف شد. طول وکتور pET-32a (+) از طول bp 5900 به bp 5434 کاهش یافت (bp 466 کاهش طول). همچنین سایت شناسایی آنزیمهای محدودالاثر Sfi-I ،BamH-I و EcoR-I در توالی pET-MOD جایگزین شدند (تصویر شماره 3).
با برش توالیهای شناسایی BamH-I و EcoR-I، توالیهای چسبنده برای اتصال ژن پروتئین هدف با دم چسبنده مشابه ایجاد شد. پس از برش وکتور pET-MOD با Sfi-I، پلاسمید خطی با انتهای چسبنده سازگار با انتهای چسبنده ژن ELP (حاصل از الیگومریزهشدن با روش RDL) که توسط Bgl-I و pflM-I برش خورده بود، تولید شد. توالی نوکلئوتیدی کدکننده GGSGGSG (گلیسین + سیستئین) به عنوان ناحیه لینکر منعطف بین توالی پروتئین هدف و تگ ELP و توالی نوکلئوتیدی کدکننده WYWYW (تریپتوفان + تیروزین) در جهت برآورد غلظت پروتئین نوترکیب، به توالی MOD اضافه شد (تصویر شماره 4).
پلاسمید نوترکیبشده از سلول ترانسفرمشده تخلیص شد و تشکیل آن بر اساس اندازه پلاسمید مشخص شد (تصویر شماره 5). نهایتاً برای تأیید پلاسمید نوترکیب pET-MOD ،Colony-PCR انجام گرفت و حضور باند bp 160 روی ژل آگارز یک درصد و توالییابی ژن حاصل، صحت کلونینگ را نشان داد (تصویر شماره 6). توالی پلاسمید pET-MOD حاصل با کد KP834588/1 دردسترس است.
بحث
در این مطالعه، توالی bp 111 طراحی شد که حاوی جایگاه برش برای تولید فیوژن پروتئین نوترکیب در کنار تگ ELP بود و نیز شامل جایگاه برش مورد نیاز برای الیگومریزهکردن ELP، توالی نوکلئوتیدی کدکننده GGSGGSG (گلیسین + سیستئین) به عنوان ناحیه لینکر منعطف بین توالی پروتئین هدف و تگ ELP، توالی نوکلئوتیدی کدکننده WYWYW (تریپتوفان + تیروزین) در جهت برآورد غلظت پروتئین نوترکیب و سایر توالیهای لازم برای بیان و خالصسازی پروتئین بود. این توالی پس سنتز مابین جایگاه برش XbaI و XhoI در وکتور بیانی pET-32a (+) کلون شد. درنتیجه وکتور pET-MOD، با کاهش طول bp 466 و دارابودن توالیهای لازم برای تولید فیوژن پروتئین نوترکیبِ دارای دنباله تخلیصی ELP و توالی لازم برای الیگومریزهکردن ELP ساخته شد.
پلیپپتیدهای شبهالاستین دستهای از بیوپلیمرهای حساس به دما با کاربردهای بیوتکنولوژی و زیستپزشکی گوناگون هستند. ELP ویژگیهای منحصربهفردی دارد از جمله اینکه میتواند به صورت ژنتیکی کد شود و از این طریق فرصت کنترل بر توالی آمینواسید و وزن مولکولی را فراهم میکند. دمای تغییر (Tt) مولکول ELP تحت کنترل فاکتورهای خارجی و داخلی همانند طول مولکول ELP قرار دارد. بنابراین طراحی ELPها برای استفادههای ویژه امکانپذیر است. به علت تأثیرپذیری حرارتی مولکول ELP، خالصسازی به واسطه کروماتوگرافی برای تخلیص پروتئین نیاز نیست. از این گذشته، ELP زیستتخریبپذیر، زیستسازگار و غیرایمونولوژیک و غیرسمی است و میتواند به میزان زیادی بیان شود [20 ،19]. تولید مقدار فراوان پروتئین فیوژن زیستفعال، موضوع حیاتی در بیوتکنولوژی است و ELP فیوژن، انتخاب مناسبی برای این موضوع است. محل قرارگیری و جهتگیری ELP نسبت به پروتئین هدف، اثر مهمی بر فعالیت اختصاصی و میزان بیان پروتئین هدف دارد. هنگامی که ELP در C- ترمینال پروتئین هدف قرار گرفته باشد (Pro-ELP)، پروتئین هدف بیشتری در مقایسه با هنگامی که ELP در N- ترمینال پروتئین هدف قرار دارد (ELP-Pro) به دست میآید [21]. همچنین میزان تولید پروتئین ELPهای بلند کمتر از میزان انواع کوتاه آن است [22]. مشخص شده است که تگ ELP ممکن است بر اساس اندازه و جهت قرارگیری، همانند بسیاری از تگها، زیستفعالی پروتئین فیوژنشده را کاهش دهد [23].
در مطالعات مختلفی که در زمینه تولید فیوژن پروتئین نوترکیب و تگ ELP، صورت گرفته است، به منظور کنار هم قراردادن این ژنها در کنار هم محققان از روشهای مختلفی از جمله سنتز طول کامل ژن موردنظر استفاده کردند، که این امر علاوه هزینهبربودن، به خاطر طولانیبودن توالی زمانبر و دارایی پیچیدگی سنتز خواهد بود [24]. در روش دیگر از کلونسازی ابتدایی در وکتور غیربیانی و سپس سابکلونینگ استفاده شده است که این روش نیز زمانبر و نیز به علت غیراختصاصیبودن وکتورها، در الیگومریزهکردن پیچیدگی دارد [26 ،25].
در مطالعه انجامشده توسط عمومی و همکاران، برای ساخت کاست 8xELP-Intein-hEGF به صورت چندمرحلهای سه توالی مورد نظر در pUC57 کلون شد و پس از تکمیلشدن سازه در وکتور بیانی pET15b بیان شد [27] که با توجه به چندمرحلهای بودن بر پیچیدگی کار میافزاید، علاوه بر این توالی 8xELP در خارج از وکتور طراحی و سپس کلون شد. در حالی که در وکتور pET-MOD امکان الیگومریزهکردن و تنظیم طول موردنظر بر اساس نیاز ممکن است. همچنین با توجه سایت برش و توالیهای در نظر گرفته شده در وکتور طراحیشده، امکان استفاده از این وکتور همانند وکتور تجاری جهت کلونکردن انواع پروتئینهای نوترکیب در کنار تگ ELP، ممکن است.
گروه تحقیقاتی ما، در مطالعات قبلی از وکتور دستکاریشده به منظور الیگومریزهکردن ELP استفاده کردند [28]، ولی با توجه برخی از معایب، از جمله احتیاج به وجود اسیدآمینههای دارای زنجیره جانبی آروماتیک در ساختار پروتئین نوترکیب، به منظور محاسبه غلظت پروتئین به وسیله جذب نور UV و نیز نبود طراحی لینکر منعطف بین پروتئین نوترکیب و تگ ELP، احتمال اختلال در عملکرد پروتئین نوترکیب، بهویژه در صورتی که این پروتئین فاکتور رشد باشد، وجود داشت.
در این مطالعه برای اولینبار، با استفاده از وکتورهای pET و ژن سنتزی MOD، وکتور اختصاصی pET-MOD به منظور استفاده در تولید مقادیر بالای پروتئین فیوژن زیستفعال با قابلیت الیگومریزهکردن تگ ELP، طراحی و ساخته شد. طراحی ژن سنتتیک MOD بر اساس نیازهای زیر انجام گرفته است: 1. کاهش طول توالی وکتور pET-MOD از طریق حذف توالی غیرضرور موجود در وکتور پایه pET-32a (+)، به منظور کاهش بار اضافی بر سلول میزبان وکتور و در نتیجه افزایش تولید پروتئین فیوژن موردنظر در میزبان سلولی؛ 2. اضافهکردن توالی محل شناسایی Sfi-I که مکمل ژن insert حاصل از الیگومریزهشدن ژن ELP تولیدشده با تکنیک RDL است و پیچیدگی ناشی از الیگومریزهکردن ژن ELP را در وکتورهای غیراختصاصی کاهش خواهد داد؛ 3. الحاق توالی شناسایی BamHI و EcoRI به منظور الحاق توالی و ساخت پروتئین فیوژن با ELP؛ 4. الحاق جعبه توالی نوکلئوتیدی کدکننده لینکر انعطافپذیر بین تگ ELP و پروتئین هدف، به منظور کاهش تداخل فضایی بر فعالیت پروتئین نوترکیب، بهویژه در مورد تأثیر بر عملکرد فاکتورهای رشد فیوژنشده با تگ ELP 5. الحاق جعبه توالی نوکلئوتیدی کدکننده آمینواسیدها با زنجیره جانبی آروماتیک برای جذب نور UV پروتئین نوترکیب ( به منظور محاسبه غلظت پروتئین)، بهویژه در مورد پروتئینهای فاقد اسیدآمینههای آروماتیک [29].
علاوه بر این، pET-MOD دارای توالی 6XHis-Tag در انتهای C تگ ELP در ساختار بیانی منطبق با کدون پروتئین فیوژن است. این ساختار از شش آمینواسید هستیدین متوالی تشکیل شده است که امکان تخلیص پروتئین نوترکیب فیوژن با استفاده از رزینها را فراهم میکند. به علاوه، حضور تگ هیستیدینی امکان استفاده از آن را به عنوان اپیتوپ جهت تشخیص پروتئین با استفاده از آنتیبادی منوکلونال یا کونژوگه با آنزیم nitrilotriacetic acid-nickel فراهم میکند.6XHis-Tag به صورت نرمال بر ساختار و فعالیت پروتئین نوترکیب تأثیرگذار نیست [30].
با توجه به امکان pET-MOD در خالصسازی پروتئین نوترکیب با استفاده از روش ترکیبی تگ ELP و تگهای هیستیدین و درنتیجه خالصسازی پشت سرهم و کاملکننده همدیگر، امکان حضور آلودگی در محلول نهایی به صورت محسوسی کاهش خواهد یافت.
با توجه به ویژگیهای pET-MOD، استفاده از این وکتور جهت خالصسازی پروتئین نوترکیب و نیز تولید فیوژن پروتئین با تگELP، به منظور استفاده به عنوان داربست حاوی الاستین به عنوان بخشی از ماتریکس خارج سلولی از یک طرف و از طرف دیگر وجود فاکتورهای رشد بر اساس مطالعه موردنظر، جهت مطالعات مختلف از جمله ترمیم زخم پیشنهاد میشود.
نتیجهگیری
در این مطالعه، طراحی و ساخت پلاسمید pET-MOD (5/4 Kbp) با جایگزینی بخشی از توالیهای pET-32a (+) به منظور تولید وکتور مناسب، در جهت ملحقکردن ژن ELP و پروتئین هدف و تولید بیومتریال فعال در مطالعات آتی انجام گرفت.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه علومپزشکی اراک با کد 11-146-92 تصویب شد.
حامی مالی
این مقاله با حمایت مالی معاونت پژوهشی دانشگاه علوم پزشکی اراک انجام شده است.
مشارکت نویسندگان
محمدرضا سلیمان ومصطفی خلیلی: تحقیق و بررسی، نگارش پیشنویس؛ علیرضا سلیمان میگونی: نگارش پیشنویس، تحلیل؛ مریم باعزم: نظارت، مدیریت پروژه، ویراستاری و نهاییسازی نوشت.
تعارض منافع
نویسندگان تصریح میکنند هیچگونه تضاد منافعی در خصوص پژوهش حاضر نداشتند.
تشکر و قدردانی
نویسندگان کمال قدردانی و امتنان را از معاونت پژوهشی دانشگاه علوم پزشکی اراک دارند.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |