دوره 22، شماره 4 - ( مهر و آبان 1398 )
جلد 22 شماره 4 صفحات 133-124 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shiravand Z, Talaei A. Effect of Iron on Thyroid Function in Women With Hypothyroidism: A Double-blind Clinical Trial Study. J Arak Uni Med Sci 2019; 22 (4) :124-133
URL: http://jams.arakmu.ac.ir/article-1-6091-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6091-fa.html
شیراوند زهرا، طلایی افسانه. بررسی اثر آهن بر عملکرد تیروئید در زنان مبتلا به هیپوتیروئیدی (مطالعه کارآزمایی بالینی دوسوکور). مجله دانشگاه علوم پزشكي اراك. 1398; 22 (4) :124-133
زهرا شیراوند1 

 ، افسانه طلایی
، افسانه طلایی 

 2
2


 ، افسانه طلایی
، افسانه طلایی 

 2
2
1- گروه داخلی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.
2- گروه داخلی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران. ، afsanehtalaeii@yahoo.com
2- گروه داخلی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران. ، afsanehtalaeii@yahoo.com
متن کامل [PDF 2383 kb]
(1668 دریافت)
| چکیده (HTML) (2457 مشاهده)
نتایج نشان داد میانگین TSH در پایان مطالعه در گروه آزمایش کاهشی معنادار دارد، اما در گروه کنترل افزایش داشته که البته معنادار نبوده است (جدول شماره 2). همچنین میانگین T4 و T3 در گروه آزمایش، افزایش معنادار آماری دارد ولی در گروه کنترل کاهش غیرمعنادار دارد (جدول شماره 2).
از طرفی نتایج آزمون آنکووا نیز نشان میدهد اختلاف میانگین TSH و T4 و T3 در گروههای موردمطالعه (کنترل و آزمایش) از نظر آماری معنادار است (0/05>P).
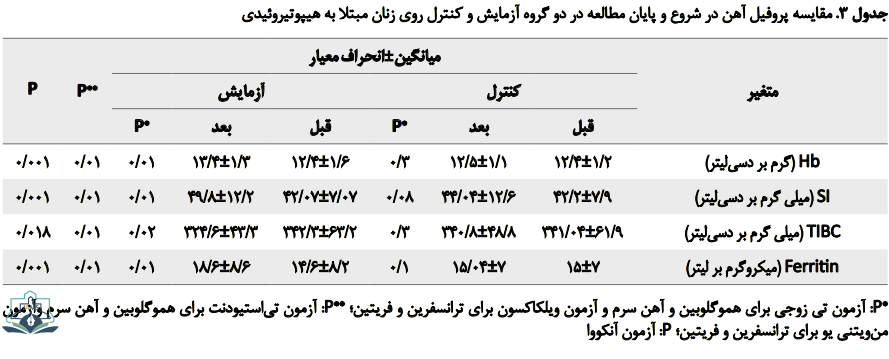
هموگلوبین (Hb) نیز در گروه آزمایش افزایش معنادارآماری دارد، ولی در گروه کنترل افزایش معنادار آماری ندارد. میانگین آهن سرم (SI) نیز بعد از مداخله افزایش معنادار دارد (جدول شماره 3). ترانسفرین در گروه آزمایش کاهش معنادار آماری دارد. فریتین نیز در پایان مطالعه در گروه مداخله افزایش آماری معناداری دارد (جدول شماره 3).
نتایج آزمون آنکووا نشان میدهد اختلاف میانگین Hb و SI و TIBC و Ferritin در گروههای موردمطالعه (کنترل و آزمایش) از نظر آماری معنادار است (0/05>P).
بحث
در این مطالعه کار آزمایی بالینی تصادفی که با هدف بررسی اثر آهن بر عملکرد تیروئید در زنان مبتلا به هیپوتیروئیدی انجام شد، نتایج مطالعه حاضر نشان داد شیوع آنمی فقر آهن در بیماران مبتلا به کمکاری تیروئید 42/6 درصد (40 نفر از 94 نفر) و بیشتر از نرمال جامعه (15 درصد) است. همچنین افزودن روزانه صد میلیگرم آهن خوراکی (فروسولفات) به مدت دو ماه به کاهش سطح سرمی TSH و افزایش T3 ،T4 یا به عبارت دیگر، بهبود هورمونهای تیروئید در زنان مبتلا به کمکاری تیروئید منجر میشود. از طرفی افزایش معنیدار سطح سرمی آهن، هموگلوبین و فریتین و کاهش TIBC نیز حکایت از اثربخشی این مقدار آهن در بهبود شاخصهای سرمی آهن دارد.
رضوانی و همکاران در سال 2016 در مطالعه خود پس از بررسی شیوع هیپوتیروئیدی در بیماران مبتلا به فقر آهن و همچنین بررسی شیوع فقر آهن در بیماران مبتلا به هیپوتیروئیدی در دو گروه 50نفری، نشان دادند بین ابتلا به هیپوتیروئیدی و فقر آهن رابطه وجود دارد [6]؛ به طوری که از کل 24 بیمار منتخب مبتلا به هیپوتیروئیدی 12 مورد (50 درصد) مبتلا به آنمی فقر آهن بودند که بیشتر از نرمال جامعه (15 درصد) است و از کل 26 بیمار منتخب مبتلا به آنمی فقر آهن هشت مورد (30/8 درصد) مبتلا به هیپوتیروئیدی بودند که در افراد نرمال جامعه پنج درصد است و نشان میدهد ابتلای همزمان این دو بیماری بیش از افراد نرمال جامعه (بدون ابتلا به هیچیک از این بیماریها) است.
داهیا و همکاران در سال 2016 نشان دادند در افراد مبتلا به کمکاری تیروئید در مقایسه با گروه سالم، سطح فریتین و آهن کاهش یافته و TIBC افزایش یافته بود و نتیجه گرفتند سطوح پایین هورمون تیروئید با سطح پایین آهن همراهی دارد [7].
روستایی و همکاران در یزد در سال 2016 نتیجهگیری کردند که سطح هموگلوبین (13/1 در برابر 13/8 گرم بر دسیلیتر)، آهن سرم (88/2 در برابر 108 میکروگرم بر دسیلیتر) و فریتین (54/6 در برابر 136 میکروگرم بر دسیلیتر) در بیماران مبتلا به هیپوتیروئیدی در مقایسه با گروه کنترل پایینتر است [8].
اختر و همکاران با مطالعه روی افراد مبتلا به آنمی و افراد بدون آنمی دریافتند میزان TSH در گروه آنمی 1/5±3/32 و در گروه کنترل 0/8±1/89 میلیواحد در لیتر بود [3]. T4 آزاد در گروه آنمی 1/6±11/77، در گروه کنترل1/36±13/1 و T3 آزاد در گروه آنمی 6/0±3 و درگروه کنترل0/6±3/31 پیکومول در لیتر بود که نشاندهنده اختلاف آماری معنیدار بین دو گروه است.
افتخاری و همکارن با مطالعه روی 94 دختر نوجوان مبتلا به کمبود آهن نشان دادند تجویز 300 میلیگرم فروسولفات پنجبار درهفته به صورت خوراکی سبب افزایش معنیداری در T3RU ،T3 ،T4 و کاهش معنیدار در TSH در مقایسه با ابتدای مطالعه شد [9].
کاظمی و همکاران در سال 2010 با مطالعه روی 70 نفر که تحت درمان با لووتیروکسین بودند، دریافتند در 43 نفر در پایان ماه سوم، آنمی با دریافت لووتیروکسین اصلاح شد که نشاندهنده رابطه بین هیپوتیروئیدی و کمخونی است [10].گوکدنیز و همکاران نیز در سال 2010 نشان دادند دریافت مکملهای آهن به تغییرات آزمونهای تیروئیدی (افزایش FT4) منجر میشود [11].
دانتاس و همکاران دریافتند درمان با آهن در زنان با هیپوتیروئیدی سابکلینیکال منجر به افزایش میزان T4 سرم و کاهش TSH میشود، گرچه نتایج معنادار نبودند، ولی آنها نتیجه گرفتند مبتلایان به کمکاری تیروئید سابکلینیکال باید از نظر آنمی ارزیابی شوند تا به پاسخ مناسب تر تیروئید منجر شود [12].
سینمر و همکاران در سال 2009 نتیجهگیری کردند در صورت وجود آنمی فقر آهن در بیماران هیپوتیروئیدی سابکلینیکال، درمان همزمان آهن و لووتیروکسین به کنترل بهتر آنمی در مقایسه با آهن خوراکی بهتنهایی منجر میشود که نشاندهنده ارتباط بین هیپوتیروئیدی و آنمی است و به صورت غیر مستقیم همراستا با نتایج تحقیق ماست [13].
بسیاری از مطالعات انجامشده روی مدلهای حیوانی نیز این فرضیه را تقویت کردهاند که کمبود آهن به افزایش متابولیسم هورمونهای تیروئیدی و کاهش میزان فعالیت آنها منجر میشود [16-14]. المصری و همکاران با مطالعه روی 60 کودک نشان دادند تجویز لووتیروکسین به همراه آهن به افزایش سطح هورمونهای تیروئیدی و کاهش TSH منجر شد [17].
نتایج مطالعه رضایی نیز مشخص کرد سطح آهن سرم، هموگلوبین، فریتین و هماتوکریت در مبتلایان به کمکاری تیروئید، به مراتب پایینتر از جمعیت سالم (P=0/001) است که به شکل غیرمستقیم در راستای نتایج مطالعه ماست [18].
متن کامل: (35325 مشاهده)
مقدمه
کمکاری تیروئید یک بیماری سیستمیک است که بر همه ارگانها تأثیر میگذارد؛ از جمله آنمی که در کمکاری تیروئید به طور شایعی دیده میشود و در بررسیهای مختلف نقش هورمونهای تیروئید به طور مستقیم و غیرمستقیم در ایجاد آن نشان داده شده است، از جمله برنر و همکارانش نشان دادند کاهش هورمونهای تیروئیدی در بیماران مبتلا به هیپوتیروئیدی با کمخونی در این بیماران ارتباط دارد [1]. از طرفی فقر آهن نیز میتواند به نقص در سنتز هورمونهای تیروئیدی از طریق کاهش فعالیت آنزیم تیروئید پراکسیداز منجر شود. تیروئید پراکسیداز دارای نقش کلیدی در بیوسنتز هورمونهای تیروئیدی است.
باید این مسئله مهم را در نظر داشت که در صورت وجود آنمی فقر آهن، پاسخ درمانی هیپوتیروئیدی نیز کاهش مییابد؛ یعنی اثر یُد و مکملهای یُد خوراکی کاهش مییابد. کمخونی ناشی از فقر آهن باعث کاهش محتوای هورمونهای تیروئیدی پلاسما (T3، T4)، کاهش متابولیسم آنها، کمبود هورمونهای تیروئیدی در بافتها، کاهش آنزیم هپاتیک دیدیناز، کاهش تخریب محیطی T4 به T3 و کندکردن پاسخ TSH به هورمون آزادکنندهاش میشود. همچنین دو مرحله از ساخت هورمونهای تیروئیدی به واسطه آنزیم تیرو پراکسیداز انجام میشود که هر دو وابسته به آهن هستند [2-4].
فقر آهن میتواند روی کنترل هیپوفیزی نیز تأثیر گذاشته و باعث تغییر اتصال TSH هستهای شود که به نوبه به تغییر در متابولیسم تیروئید و نهایتاً کاهش ترشح T4 و T3 منجر میشود که آن نیز به طور بازخوردی به افزایش سطح در گردش TSH منجر میشود [5].
با توجه به اینکه هم هیپوتیروئیدی و هم فقر آهن در زنان شایع است و فقر آهن میتواند در بسیاری از فرایندهای هورمونی مؤثر باشد و در صورت عدم درمان آنمی، پاسخ درمانی هیپوتیروئیدی کاهش مییابد، عدم درمان آنمی عوارض جبرانناپذیری خواهد داشت و از طرفی درمان با آهن میتواند موجب بهبود عملکرد تیروئید و حتی کاهش دُز لووتیروکسین شود. بر همین اساس هدف پژوهش حاضر بررسی تأثیر افزودن آهن بر عملکرد تیروئید است.
مواد و روشها
در این پژوهش کارآزمایی بالینی تصادفی، 94 نفر از زنان 20 تا70ساله مبتلا به هیپوتیروئیدی تحت درمان با لووتیروکسینِ مراجعهکننده به درمانگاه غدد بیمارستان امیرالمؤمنین اراک (بیماران الزاماً مبتلا به آنمی نبودند) که TSH آنان برای حداقل شش ماه در محدوده 5/0 تا 5 واحد بینالمللی بر لیتر بود با نمونهگیری آسان، انتخاب و به صورت تصادفی با روش نمونهگیری بلوکی ساده به دو گروه تقسیم شدند.
رضایت آگاهانه از همه بیماران اخذ و فرم اطلاعات برای آنان تکمیل شد. معیارهای خروج از مطالعه عبارت بودند از: بارداری، شیردهی، بیماریهای مزمن، عدم تحمل گوارشی قرص آهن، ابتلا به سرطان تیروئید و عدم رضایت بیماران.
سطح T3 ،T4 (با روش ایمونواسی و کیت ایزوتوپ بوداپست، مجارستان) و TSH (با روش IRMA و کیت Turku, Finland) و پروفایل آهن (هموگلوبین، آهن سرم، ترانسفرین، فریتین) (کیت پارس آزمون، ایران) همه بیماران در زمان ورود به مطالعه اندازهگیری و ثبت شد. همه بیماران جهت آزمایش نمونه خون به آزمایشگاه مرجع دانشگاه علوم پزشکی اراک ارجاع داده شدند. سپس بیماران گروه آزمایش لووتیروکسین (شرکت ایران هورمون) به همراه روزانه صد میلیگرم آهن خوراکی (فروسولفات شرکت شهر دارو) و گروه کنترل علاوه بر لووتیروکسین، دارونما به شکل و اندازه یکسان با لووتیروکسین (به مدت دو ماه) دریافت کردند. مطالعه به صورت دوسوکور انجام شد؛ به طوری که کارشناس آماری، بیماران و همچنین پزشک معالج از گروهبندی و نوع داروی دریافتی بیماران مطلع نبودند. بعد از گذشت دو ماه مجدداً سطح T3-T4-TSH و پروفایل آهن در هر دو گروه اندازهگیری شد و نتایج قبل و بعد از درمان مقایسه شدند. در این مطالعه از نسخه 19 نرمافزار SPSS برای تحلیل دادهها استفاده شد.
در تجزیه و تحلیل اطلاعات، ابتدا از آزمون K-S برای بررسی توزیع نرمال دادهها استفاده شد و در صورت نرمالبودن توزیع متغیرها، از آزمونهای پارامتریک (تیاستیودنت برای مقایسه متغیرهای بین دو گروه و تی زوجی برای مقایسه درونگروهی) و در صورت غیرنرمالبودن توزیع دادهها از آزمونهای غیرپارامتریک (منویتنی یو برای مقایسه متغیرهای بین دو گروه و ویلکاکسون برای مقایسه درونگروهی) استفاده شد. همچنین از آزمون آنکووا برای بررسیهای تکمیلی و تأیید نتایج استفاده شد. سطح معنیداری آماری P کمتر از 0/05 در نظر گرفته شد.
یافتهها
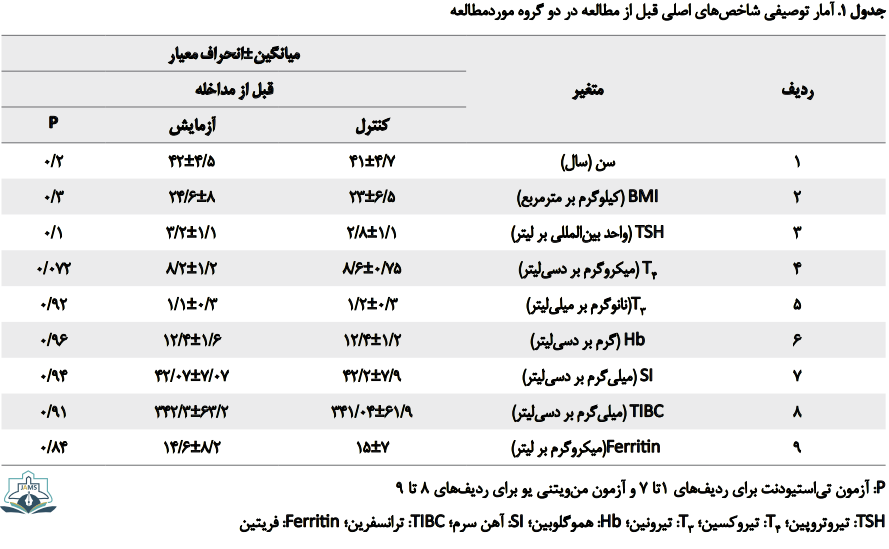
این پژوهش یک مطالعه کارآزمایی بالینی است که روی 94 بیمار با هدف بررسی اثر آهن بر عملکرد تیروئید در زنان مبتلا به هیپوتیروئیدی انجام گرفت. میانگین سن در گروه کنترل 4/7±41 سال و در گروه آزمایش4/5±42 سال بود که با توجه به آزمون تیاستیودنت اختلاف معنادار آماری وجود ندارد (0/05<P). بنابراین میتوان انتظار داشت دو گروه نسبت به سن و شاخصهای اصلی قبل از مداخله همسان باشند (جدول شماره 1).
کمکاری تیروئید یک بیماری سیستمیک است که بر همه ارگانها تأثیر میگذارد؛ از جمله آنمی که در کمکاری تیروئید به طور شایعی دیده میشود و در بررسیهای مختلف نقش هورمونهای تیروئید به طور مستقیم و غیرمستقیم در ایجاد آن نشان داده شده است، از جمله برنر و همکارانش نشان دادند کاهش هورمونهای تیروئیدی در بیماران مبتلا به هیپوتیروئیدی با کمخونی در این بیماران ارتباط دارد [1]. از طرفی فقر آهن نیز میتواند به نقص در سنتز هورمونهای تیروئیدی از طریق کاهش فعالیت آنزیم تیروئید پراکسیداز منجر شود. تیروئید پراکسیداز دارای نقش کلیدی در بیوسنتز هورمونهای تیروئیدی است.
باید این مسئله مهم را در نظر داشت که در صورت وجود آنمی فقر آهن، پاسخ درمانی هیپوتیروئیدی نیز کاهش مییابد؛ یعنی اثر یُد و مکملهای یُد خوراکی کاهش مییابد. کمخونی ناشی از فقر آهن باعث کاهش محتوای هورمونهای تیروئیدی پلاسما (T3، T4)، کاهش متابولیسم آنها، کمبود هورمونهای تیروئیدی در بافتها، کاهش آنزیم هپاتیک دیدیناز، کاهش تخریب محیطی T4 به T3 و کندکردن پاسخ TSH به هورمون آزادکنندهاش میشود. همچنین دو مرحله از ساخت هورمونهای تیروئیدی به واسطه آنزیم تیرو پراکسیداز انجام میشود که هر دو وابسته به آهن هستند [2-4].
فقر آهن میتواند روی کنترل هیپوفیزی نیز تأثیر گذاشته و باعث تغییر اتصال TSH هستهای شود که به نوبه به تغییر در متابولیسم تیروئید و نهایتاً کاهش ترشح T4 و T3 منجر میشود که آن نیز به طور بازخوردی به افزایش سطح در گردش TSH منجر میشود [5].
با توجه به اینکه هم هیپوتیروئیدی و هم فقر آهن در زنان شایع است و فقر آهن میتواند در بسیاری از فرایندهای هورمونی مؤثر باشد و در صورت عدم درمان آنمی، پاسخ درمانی هیپوتیروئیدی کاهش مییابد، عدم درمان آنمی عوارض جبرانناپذیری خواهد داشت و از طرفی درمان با آهن میتواند موجب بهبود عملکرد تیروئید و حتی کاهش دُز لووتیروکسین شود. بر همین اساس هدف پژوهش حاضر بررسی تأثیر افزودن آهن بر عملکرد تیروئید است.
مواد و روشها
در این پژوهش کارآزمایی بالینی تصادفی، 94 نفر از زنان 20 تا70ساله مبتلا به هیپوتیروئیدی تحت درمان با لووتیروکسینِ مراجعهکننده به درمانگاه غدد بیمارستان امیرالمؤمنین اراک (بیماران الزاماً مبتلا به آنمی نبودند) که TSH آنان برای حداقل شش ماه در محدوده 5/0 تا 5 واحد بینالمللی بر لیتر بود با نمونهگیری آسان، انتخاب و به صورت تصادفی با روش نمونهگیری بلوکی ساده به دو گروه تقسیم شدند.
رضایت آگاهانه از همه بیماران اخذ و فرم اطلاعات برای آنان تکمیل شد. معیارهای خروج از مطالعه عبارت بودند از: بارداری، شیردهی، بیماریهای مزمن، عدم تحمل گوارشی قرص آهن، ابتلا به سرطان تیروئید و عدم رضایت بیماران.
سطح T3 ،T4 (با روش ایمونواسی و کیت ایزوتوپ بوداپست، مجارستان) و TSH (با روش IRMA و کیت Turku, Finland) و پروفایل آهن (هموگلوبین، آهن سرم، ترانسفرین، فریتین) (کیت پارس آزمون، ایران) همه بیماران در زمان ورود به مطالعه اندازهگیری و ثبت شد. همه بیماران جهت آزمایش نمونه خون به آزمایشگاه مرجع دانشگاه علوم پزشکی اراک ارجاع داده شدند. سپس بیماران گروه آزمایش لووتیروکسین (شرکت ایران هورمون) به همراه روزانه صد میلیگرم آهن خوراکی (فروسولفات شرکت شهر دارو) و گروه کنترل علاوه بر لووتیروکسین، دارونما به شکل و اندازه یکسان با لووتیروکسین (به مدت دو ماه) دریافت کردند. مطالعه به صورت دوسوکور انجام شد؛ به طوری که کارشناس آماری، بیماران و همچنین پزشک معالج از گروهبندی و نوع داروی دریافتی بیماران مطلع نبودند. بعد از گذشت دو ماه مجدداً سطح T3-T4-TSH و پروفایل آهن در هر دو گروه اندازهگیری شد و نتایج قبل و بعد از درمان مقایسه شدند. در این مطالعه از نسخه 19 نرمافزار SPSS برای تحلیل دادهها استفاده شد.
در تجزیه و تحلیل اطلاعات، ابتدا از آزمون K-S برای بررسی توزیع نرمال دادهها استفاده شد و در صورت نرمالبودن توزیع متغیرها، از آزمونهای پارامتریک (تیاستیودنت برای مقایسه متغیرهای بین دو گروه و تی زوجی برای مقایسه درونگروهی) و در صورت غیرنرمالبودن توزیع دادهها از آزمونهای غیرپارامتریک (منویتنی یو برای مقایسه متغیرهای بین دو گروه و ویلکاکسون برای مقایسه درونگروهی) استفاده شد. همچنین از آزمون آنکووا برای بررسیهای تکمیلی و تأیید نتایج استفاده شد. سطح معنیداری آماری P کمتر از 0/05 در نظر گرفته شد.
یافتهها
این پژوهش یک مطالعه کارآزمایی بالینی است که روی 94 بیمار با هدف بررسی اثر آهن بر عملکرد تیروئید در زنان مبتلا به هیپوتیروئیدی انجام گرفت. میانگین سن در گروه کنترل 4/7±41 سال و در گروه آزمایش4/5±42 سال بود که با توجه به آزمون تیاستیودنت اختلاف معنادار آماری وجود ندارد (0/05<P). بنابراین میتوان انتظار داشت دو گروه نسبت به سن و شاخصهای اصلی قبل از مداخله همسان باشند (جدول شماره 1).
همچنین با توجه به آزمون آماری انجامشده جهت مقایسه سایر میانگینها در دو گروه (کنترل و آزمایش) قبل از مداخله، درمییابیم اختلاف معنادار آماری وجود ندارد. (0/05<P)؛ بنابراین همسانسازی گروهها قبل از مداخله وجود دارد (جدول شماره 1).
نتایج نشان داد میانگین TSH در پایان مطالعه در گروه آزمایش کاهشی معنادار دارد، اما در گروه کنترل افزایش داشته که البته معنادار نبوده است (جدول شماره 2). همچنین میانگین T4 و T3 در گروه آزمایش، افزایش معنادار آماری دارد ولی در گروه کنترل کاهش غیرمعنادار دارد (جدول شماره 2).
از طرفی نتایج آزمون آنکووا نیز نشان میدهد اختلاف میانگین TSH و T4 و T3 در گروههای موردمطالعه (کنترل و آزمایش) از نظر آماری معنادار است (0/05>P).
هموگلوبین (Hb) نیز در گروه آزمایش افزایش معنادارآماری دارد، ولی در گروه کنترل افزایش معنادار آماری ندارد. میانگین آهن سرم (SI) نیز بعد از مداخله افزایش معنادار دارد (جدول شماره 3). ترانسفرین در گروه آزمایش کاهش معنادار آماری دارد. فریتین نیز در پایان مطالعه در گروه مداخله افزایش آماری معناداری دارد (جدول شماره 3).
نتایج آزمون آنکووا نشان میدهد اختلاف میانگین Hb و SI و TIBC و Ferritin در گروههای موردمطالعه (کنترل و آزمایش) از نظر آماری معنادار است (0/05>P).
بحث
در این مطالعه کار آزمایی بالینی تصادفی که با هدف بررسی اثر آهن بر عملکرد تیروئید در زنان مبتلا به هیپوتیروئیدی انجام شد، نتایج مطالعه حاضر نشان داد شیوع آنمی فقر آهن در بیماران مبتلا به کمکاری تیروئید 42/6 درصد (40 نفر از 94 نفر) و بیشتر از نرمال جامعه (15 درصد) است. همچنین افزودن روزانه صد میلیگرم آهن خوراکی (فروسولفات) به مدت دو ماه به کاهش سطح سرمی TSH و افزایش T3 ،T4 یا به عبارت دیگر، بهبود هورمونهای تیروئید در زنان مبتلا به کمکاری تیروئید منجر میشود. از طرفی افزایش معنیدار سطح سرمی آهن، هموگلوبین و فریتین و کاهش TIBC نیز حکایت از اثربخشی این مقدار آهن در بهبود شاخصهای سرمی آهن دارد.
رضوانی و همکاران در سال 2016 در مطالعه خود پس از بررسی شیوع هیپوتیروئیدی در بیماران مبتلا به فقر آهن و همچنین بررسی شیوع فقر آهن در بیماران مبتلا به هیپوتیروئیدی در دو گروه 50نفری، نشان دادند بین ابتلا به هیپوتیروئیدی و فقر آهن رابطه وجود دارد [6]؛ به طوری که از کل 24 بیمار منتخب مبتلا به هیپوتیروئیدی 12 مورد (50 درصد) مبتلا به آنمی فقر آهن بودند که بیشتر از نرمال جامعه (15 درصد) است و از کل 26 بیمار منتخب مبتلا به آنمی فقر آهن هشت مورد (30/8 درصد) مبتلا به هیپوتیروئیدی بودند که در افراد نرمال جامعه پنج درصد است و نشان میدهد ابتلای همزمان این دو بیماری بیش از افراد نرمال جامعه (بدون ابتلا به هیچیک از این بیماریها) است.
داهیا و همکاران در سال 2016 نشان دادند در افراد مبتلا به کمکاری تیروئید در مقایسه با گروه سالم، سطح فریتین و آهن کاهش یافته و TIBC افزایش یافته بود و نتیجه گرفتند سطوح پایین هورمون تیروئید با سطح پایین آهن همراهی دارد [7].
روستایی و همکاران در یزد در سال 2016 نتیجهگیری کردند که سطح هموگلوبین (13/1 در برابر 13/8 گرم بر دسیلیتر)، آهن سرم (88/2 در برابر 108 میکروگرم بر دسیلیتر) و فریتین (54/6 در برابر 136 میکروگرم بر دسیلیتر) در بیماران مبتلا به هیپوتیروئیدی در مقایسه با گروه کنترل پایینتر است [8].
اختر و همکاران با مطالعه روی افراد مبتلا به آنمی و افراد بدون آنمی دریافتند میزان TSH در گروه آنمی 1/5±3/32 و در گروه کنترل 0/8±1/89 میلیواحد در لیتر بود [3]. T4 آزاد در گروه آنمی 1/6±11/77، در گروه کنترل1/36±13/1 و T3 آزاد در گروه آنمی 6/0±3 و درگروه کنترل0/6±3/31 پیکومول در لیتر بود که نشاندهنده اختلاف آماری معنیدار بین دو گروه است.
افتخاری و همکارن با مطالعه روی 94 دختر نوجوان مبتلا به کمبود آهن نشان دادند تجویز 300 میلیگرم فروسولفات پنجبار درهفته به صورت خوراکی سبب افزایش معنیداری در T3RU ،T3 ،T4 و کاهش معنیدار در TSH در مقایسه با ابتدای مطالعه شد [9].
کاظمی و همکاران در سال 2010 با مطالعه روی 70 نفر که تحت درمان با لووتیروکسین بودند، دریافتند در 43 نفر در پایان ماه سوم، آنمی با دریافت لووتیروکسین اصلاح شد که نشاندهنده رابطه بین هیپوتیروئیدی و کمخونی است [10].گوکدنیز و همکاران نیز در سال 2010 نشان دادند دریافت مکملهای آهن به تغییرات آزمونهای تیروئیدی (افزایش FT4) منجر میشود [11].
دانتاس و همکاران دریافتند درمان با آهن در زنان با هیپوتیروئیدی سابکلینیکال منجر به افزایش میزان T4 سرم و کاهش TSH میشود، گرچه نتایج معنادار نبودند، ولی آنها نتیجه گرفتند مبتلایان به کمکاری تیروئید سابکلینیکال باید از نظر آنمی ارزیابی شوند تا به پاسخ مناسب تر تیروئید منجر شود [12].
سینمر و همکاران در سال 2009 نتیجهگیری کردند در صورت وجود آنمی فقر آهن در بیماران هیپوتیروئیدی سابکلینیکال، درمان همزمان آهن و لووتیروکسین به کنترل بهتر آنمی در مقایسه با آهن خوراکی بهتنهایی منجر میشود که نشاندهنده ارتباط بین هیپوتیروئیدی و آنمی است و به صورت غیر مستقیم همراستا با نتایج تحقیق ماست [13].
بسیاری از مطالعات انجامشده روی مدلهای حیوانی نیز این فرضیه را تقویت کردهاند که کمبود آهن به افزایش متابولیسم هورمونهای تیروئیدی و کاهش میزان فعالیت آنها منجر میشود [16-14]. المصری و همکاران با مطالعه روی 60 کودک نشان دادند تجویز لووتیروکسین به همراه آهن به افزایش سطح هورمونهای تیروئیدی و کاهش TSH منجر شد [17].
نتایج مطالعه رضایی نیز مشخص کرد سطح آهن سرم، هموگلوبین، فریتین و هماتوکریت در مبتلایان به کمکاری تیروئید، به مراتب پایینتر از جمعیت سالم (P=0/001) است که به شکل غیرمستقیم در راستای نتایج مطالعه ماست [18].
مطالعات متعددی همچنین ارتباط آهن با گواتر را نشان دادهاند؛ مثلاً در زنان باردار نشان داده شده است کمخونی فقر آهن باعث بدترشدن گواتر ناشی از کمبود ید میشود و کمبود مزمن ید به نوبه خود در زنانی که دچار کمخونی ناشی از فقر آهن هستند، باعث بروز بیشتر کمکاری تحت بالینی تیروئید میشود. همچنین زنان باردار سالمی که در نواحی که گواتر، بومی است، زندگی میکنند، به عنوان یک گروه در معرض خطرکمخونی ناشی از فقر آهن در سه ماهه سوم بارداری محسوب میشوند [19]. در یک بررسی انجامشده روی ۲۹۴ کودک، مشخص شد کودکانی که به گواتر مبتلا بودند، غلظت هموگلوبین کمتری داشتند. در این کودکان غلظت تیروکسین پایینتر، ولی غلظت تیروتروپین بیشتر از کودکان سالم بود [20].
البته مطالعاتی نیز وجود دارند که نشان میدهند تفاوت آماری معنیداری در شیوع کمخونی بین افراد مبتلا و غیرمبتلا به گواتر وجود ندارد و همچنین شیوع گواتر بین افراد مبتلا و غیرمبتلا به کمخونی اختلاف نداشته است [21]. با این حال مکمل آهن میتواند در کودکان مبتلا به گواتر که در عین حال دچار کمخونی ناشی از فقر آهن هستند، کارایی محلولهای خوراکی ید را افزایش دهد (45 درصد در برابر 21 درصد) [22].
بر خلاف نتایج مطالعه حاضر، در مطالعات معدودی نظیر مطالعه ایپک در ترکیه در سال 2011 روی 90 بیمار مبتلا به هیپوتیروئیدی و 38 کودک سالم یک تا 14ساله، عدم ارتباط فقر آهن با سطح آزاد هورمونهای تیروئیدی مطرح شده است که دلیل این اختلاف شاید مربوط به تفاوت سنی بیماران که عمدتاً گروه کودکان بودهاند و نیز شرایط جغرافیایی (میزان ید منطقه) و معیارهای ورود متفاوت باشد [23].
همچنین در مطالعه کمپل و همکاران که به صورت کارآزمایی بالینی روی 40 بیمار مبتلا به هیپوتیروئیدی اولیه انجام شد، تجویز 300 میلیگرم فروسولفات به مدت 12 هفته به همراه دُز معمول لووتیروکسین، به افزایش TSH شد، ولی تأثیری بر سطح هورمونهای تیروئید و دُز درمانی نداشت [24]؛ این نتایج با نتایج مطالعه ما مغایرت دارد که توجیه آن ممکن است مربوط به این نکته باشد که بیماران فروسولفات و لووتیروکسین را در یک زمان و بدون فاصله مصرف میکردند که این میتواند به باندشدن آهن به لووتیروکسین و درنتیجه عدم جذب آن منجر شود.
فرایند سنتز هورمونهای تیروئید به واسطه ژنهای متعددی صورت میگیرد که نقص در این ژنها که عمدتاً به صورت ارثی با توارث اتوزوم مغلوب هستند، میتواند به اختلال در سنتز هورمونها منجر شود [25]. در بین ژنهای مختلف مؤثر در اختلال سنتز هورمونی، اختلال در ژن تیروئیدپراکسیداز واقع در کروموزوم 2P25 به عنوان شایعترین و مهمترین عامل شناخته شده است [26]. این ژن دارای ۱۷ اگزون و اندازه تقریبی 150 کیلو باز جفت کروموزوم است و گلیکوپروتئینی (تیروئید پراکسیداز) را که محتوای آهن دارد، کد میکند که به غشای داخلی سلولهای فولیکولی غده تیروئید متصل میشود و نقش اصلی را در سنتز هورمونهای تیروئیدی ایفا میکند [27]. این آنزیم دارای سه نقش کلیدی در فرایند سنتز هورمونهای تیروئیدی است. اول اکسیدهکردن ید، سپس انتقال ید به اسیدآمینه تیروزین در پروتئین تیروگلوبین و نهایتاً اتصال تیروزینهای یددارشده مجاور به منظور شکلگیری هورمونهای تیروئید که در هر سه مورد، وجود آهن در ساختمان این گلیکو پروتئین لازم است [28]. همچنین ممکن است عملکرد آنزیمهای دیگر دارای محتوای آهن، مانند سیتوکروم اکسیداز و میلوپراکسیداز نیز دچار اختلال شود [29، 30].
فعالیت آنزیم تیروکسین دیدیناز نیز وابسته به آهن است و این آنزیم در تبدیل T4 به T3 نقش اساسی دارد [28]. بنابراین مکانیسم احتمالی دیگر در بهبود شاخصهای هورمونهای تیروئیدی و بهویژه افزایش سطح سرمی T3 در مطالعه حاضر، ممکن است مربوط به تأثیر آهن تجویزشده بر فعالیت آنزیم تیروکسین دی یدیناز باشد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد شیوع آنمی فقر آهن در بیماران مبتلا به کمکاری تیروئید 42/1 درصد (40 نفر از 94 نفر) و بیشتر از نرمال جامعه (15درصد) است. همچنین افزودن روزانه صد میلیگرم آهن خوراکی (فروسولفات) به مدت دو ماه به کاهش سطح سرمی TSH و افزایش T3 ،T4 یا به عبارت دیگر، بهبود هورمونهای تیروئید در زنان مبتلا به کمکاری تیروئید منجر میشود. با توجه به نتایج مذکور به نظر میرسد شاخصهای سرمی آهن بهتر است در بیماران مبتلا به کمکاری تیروئید بررسی شوند و در صورت وجود آنمی فقر آهن، درمان صورت گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این تحقیق در کمیته اخلاق پژوهش دانشگاه علوم پزشکی اراک با کد 1396154تصویب شد و در مرکز ثبت کارآزمایی بالینی با کد IRCT20151114025031 به ثبت رسید.
حامی مالی
نتایج این تحقیق حاصل پایاننامه دکتری نویسنده اول، زهرا شیراوند، گروه داخلی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک است.
مشارکت نویسندگان
تمامی نویسندگان معیارهای استاندارد نویسندگی بر اساس پیشنهادهای کمیته بینالمللی ناشران مجلات پزشکی (ICMJE) را دارند.
تعارض منافع
طبق نظر نویسندگان هیچگونه تضاد منافعی در این پژوهش وجود ندارد.
تشکر و قدردانی
بدینوسیله نویسندگان از همکاری شورای پژوهشی دانشگاه علوم پزشکی اراک و مشاور آماری محترم خانم فاطمه رفیعی نهایت سپاس را دارند.
البته مطالعاتی نیز وجود دارند که نشان میدهند تفاوت آماری معنیداری در شیوع کمخونی بین افراد مبتلا و غیرمبتلا به گواتر وجود ندارد و همچنین شیوع گواتر بین افراد مبتلا و غیرمبتلا به کمخونی اختلاف نداشته است [21]. با این حال مکمل آهن میتواند در کودکان مبتلا به گواتر که در عین حال دچار کمخونی ناشی از فقر آهن هستند، کارایی محلولهای خوراکی ید را افزایش دهد (45 درصد در برابر 21 درصد) [22].
بر خلاف نتایج مطالعه حاضر، در مطالعات معدودی نظیر مطالعه ایپک در ترکیه در سال 2011 روی 90 بیمار مبتلا به هیپوتیروئیدی و 38 کودک سالم یک تا 14ساله، عدم ارتباط فقر آهن با سطح آزاد هورمونهای تیروئیدی مطرح شده است که دلیل این اختلاف شاید مربوط به تفاوت سنی بیماران که عمدتاً گروه کودکان بودهاند و نیز شرایط جغرافیایی (میزان ید منطقه) و معیارهای ورود متفاوت باشد [23].
همچنین در مطالعه کمپل و همکاران که به صورت کارآزمایی بالینی روی 40 بیمار مبتلا به هیپوتیروئیدی اولیه انجام شد، تجویز 300 میلیگرم فروسولفات به مدت 12 هفته به همراه دُز معمول لووتیروکسین، به افزایش TSH شد، ولی تأثیری بر سطح هورمونهای تیروئید و دُز درمانی نداشت [24]؛ این نتایج با نتایج مطالعه ما مغایرت دارد که توجیه آن ممکن است مربوط به این نکته باشد که بیماران فروسولفات و لووتیروکسین را در یک زمان و بدون فاصله مصرف میکردند که این میتواند به باندشدن آهن به لووتیروکسین و درنتیجه عدم جذب آن منجر شود.
فرایند سنتز هورمونهای تیروئید به واسطه ژنهای متعددی صورت میگیرد که نقص در این ژنها که عمدتاً به صورت ارثی با توارث اتوزوم مغلوب هستند، میتواند به اختلال در سنتز هورمونها منجر شود [25]. در بین ژنهای مختلف مؤثر در اختلال سنتز هورمونی، اختلال در ژن تیروئیدپراکسیداز واقع در کروموزوم 2P25 به عنوان شایعترین و مهمترین عامل شناخته شده است [26]. این ژن دارای ۱۷ اگزون و اندازه تقریبی 150 کیلو باز جفت کروموزوم است و گلیکوپروتئینی (تیروئید پراکسیداز) را که محتوای آهن دارد، کد میکند که به غشای داخلی سلولهای فولیکولی غده تیروئید متصل میشود و نقش اصلی را در سنتز هورمونهای تیروئیدی ایفا میکند [27]. این آنزیم دارای سه نقش کلیدی در فرایند سنتز هورمونهای تیروئیدی است. اول اکسیدهکردن ید، سپس انتقال ید به اسیدآمینه تیروزین در پروتئین تیروگلوبین و نهایتاً اتصال تیروزینهای یددارشده مجاور به منظور شکلگیری هورمونهای تیروئید که در هر سه مورد، وجود آهن در ساختمان این گلیکو پروتئین لازم است [28]. همچنین ممکن است عملکرد آنزیمهای دیگر دارای محتوای آهن، مانند سیتوکروم اکسیداز و میلوپراکسیداز نیز دچار اختلال شود [29، 30].
فعالیت آنزیم تیروکسین دیدیناز نیز وابسته به آهن است و این آنزیم در تبدیل T4 به T3 نقش اساسی دارد [28]. بنابراین مکانیسم احتمالی دیگر در بهبود شاخصهای هورمونهای تیروئیدی و بهویژه افزایش سطح سرمی T3 در مطالعه حاضر، ممکن است مربوط به تأثیر آهن تجویزشده بر فعالیت آنزیم تیروکسین دی یدیناز باشد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد شیوع آنمی فقر آهن در بیماران مبتلا به کمکاری تیروئید 42/1 درصد (40 نفر از 94 نفر) و بیشتر از نرمال جامعه (15درصد) است. همچنین افزودن روزانه صد میلیگرم آهن خوراکی (فروسولفات) به مدت دو ماه به کاهش سطح سرمی TSH و افزایش T3 ،T4 یا به عبارت دیگر، بهبود هورمونهای تیروئید در زنان مبتلا به کمکاری تیروئید منجر میشود. با توجه به نتایج مذکور به نظر میرسد شاخصهای سرمی آهن بهتر است در بیماران مبتلا به کمکاری تیروئید بررسی شوند و در صورت وجود آنمی فقر آهن، درمان صورت گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این تحقیق در کمیته اخلاق پژوهش دانشگاه علوم پزشکی اراک با کد 1396154تصویب شد و در مرکز ثبت کارآزمایی بالینی با کد IRCT20151114025031 به ثبت رسید.
حامی مالی
نتایج این تحقیق حاصل پایاننامه دکتری نویسنده اول، زهرا شیراوند، گروه داخلی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک است.
مشارکت نویسندگان
تمامی نویسندگان معیارهای استاندارد نویسندگی بر اساس پیشنهادهای کمیته بینالمللی ناشران مجلات پزشکی (ICMJE) را دارند.
تعارض منافع
طبق نظر نویسندگان هیچگونه تضاد منافعی در این پژوهش وجود ندارد.
تشکر و قدردانی
بدینوسیله نویسندگان از همکاری شورای پژوهشی دانشگاه علوم پزشکی اراک و مشاور آماری محترم خانم فاطمه رفیعی نهایت سپاس را دارند.
References
- Brenner B, Fandrey J, Jelkmann W, Serum immunoreactive erythropoietin in hyper- d hypothyroidism: Clinical observations related to cell culture studies. Eur J Haematol. 1994; 53(1):6-10. [DOI:10.1111/j.1600-0609.1994.tb00171.x]
- Metwalley K, Farghaly H, Hassan A. Thyroid function in egyptian primary school children with iron deficiency anemia: Relationship to intellectual function. J Thyroid Res. 2013; 10(3):91-5. [DOI:10.4103/0973-0354.116131]
- Akhter S, Nahar Z, Parvin S, Alam A, Sharmin S, Arslan M, Thyroid status in patients with low serum ferritin level. Bangladesh J Biochem. 2013; 5(1):5-11. [DOI:10.3329/bjmb.v5i1.13424]
- Beard J, Brigham D, Kelley S, Green M. Plasma thyroid hormone kinetics are altered in irondeficient rats. J Nutr. 1998; 128(8):1401-8. [DOI:10.1093/jn/128.8.1401]
- Ravanbod M, Asadipooya K, Kalantarhormozi M, Nabipour I, Omrani G. Treatment of irondeficiency anemia in patients with subclinical hypothyroidism. Am J Med. 2013; 126(5):420-4. [DOI:10.1016/j.amjmed.2012.12.009]
- Rezvani M, Malek F, Ghotaslou A, Kamali M. [Investigation of relation between iron deficiency anemia and hypothyroidism (Persian)]. Razi J Med Sci. 2016; 23(149):89-97.
- Dahiya K, Verma M, Dhankhar R, Ghalaut V, Ghalaut P. Thyroid profile and iron metabolism: Mutual relationship inhypothy roidism. Biomed Res. 2016; 27(4):1212-5.
- Rostaei N, Vakili M., Zavar-reza J, Rezaie S, Shirvani AR. The relationship between thyroid hormone levels and body iron status in iranian hypothyroidism patients. Int J Med Lab. 2016; 3(3):176-84.
- Eftekhari M, Eshraghian M, Mozafari khosravi H, Saadat N. The effect of iron deficiency compensation on thyroid gland in Iranian adolescent girls suffering from iron deficiency. Pak J Biol Sci. 2007; 15(10):255-60. [DOI:10.3923/pjbs.2007.255.260]
- Kazemi M, Shahriairi A, Samedanifrard S, Abdolapoor E, Allameh F. The association between hypothyroidism and anemia: A clinical study. Int J Hematol Oncol Stem Cell Res. 2010; 4(3):6-9.
- Gökdeniz E, Demin C, Dilek I. The effects of iron deficiency anemia on the thyroid functions. J Cli Exp Investig. 2010; 1(3):156-60. [DOI:10.5799/ahinjs.01.2010.03.0033]
- Duntas L, Papanastasiou L, Mantzou E, Koutras D. Incidence of sideropenia and effects of iron repletion treatment in women with subclinical hypothyroidism. Exp Clin Endocrinol Diabetes. 1999; 107(06):356-60. [DOI:10.1055/s-0029-1212126]
- Cinemre H, Bilir C, Gokosmanoglu F, Bahcebasi T. Hematologic effects of levothyroxine in iron-deficient subclinical hypothyroid patients: A randomized, double-blind, controlled study. J Cli Endocrinol Metabol. 2009; 94(1):151-6. [DOI:10.1210/jc.2008-1440]
- Dillman ER, Gale CH, Green WI, Johnson DG, Mackler BR, Finch CL. Hypothermia in iron deficiency due to altered triiodothyronine metabolism. Am J Physiol-Regul Integr Comp Physiol. 1980; 239(5): 377-8. [DOI:10.1152/ajpregu.1980.239.5.R377]
- Hess SY, Zimmermann MB, Arnold M, Langhans W, Hurrell RF. Iron deficiency anemia reduces thyroid peroxidase activity in rats. J Nutr. 2002; 132(7):1951-5. [DOI:10.1093/jn/132.7.1951]
- Tang F, Wong TM, Loh TT. Effects of cold exposure or TRH on the serum TSH levels in the iron-deficient rat. Horm and Metab Res. 1988; 20(10):616-9. [DOI:10.1055/s-2007-1010899]
- El-Masry H, Hamed AM, Hassan MH, Fayed HM, Abdelzaher MH. Thyroid function among children with iron deficiency anaemia: Pre and post iron replacement therapy. J Cli Diagn Res. 2018; 12(1):1-5. [DOI:10.7860/JCDR/2018/32762.11023]
- Rezaie S, Shirvani AR. The relationship between thyroid hormone levels and body iron status in iranian hypothyroidism patients. Int J Med Lab. 2016; 3(3):176-84.
- Zeltser ME, Mezinova NN, Kobzar NN, Bazarbekova RB, Nazyrov AT, Kim GG, et al. [Thyroid status in anemic pregnant women under conditions of endemic goiter (Russian)]. Probl Endokrinol (Mosk). 1994; 40(5):20-2.
- Brzostek J. Concentration of thyroxine, triiodothyronine and thyrotropin in blood serum of children with goitre living in the region of Debica. Przegl Lek. 1996; 53(3):150-4.
- Florentino RF, Tanchoco CC, Rodriguez MP, Cruz AJ. Interactions among micronutrients deficiencies and undernutritions in the Philippines. Asia Pacific Clinl Nutr. 1996; 5(3):175-80.
- Zimmermann M, Adou P, Torresani T, Zeder C, Hurrell R. Iron supplementation in goitrous, iron-deficient children improves their response to oral iodized oil. Eur J Endocrinol. 2000; 142(1):217-23. [DOI:10.1530/eje.0.1420217]
- Ipek I, Kaçmaz E, Bozaykut A, Sezer RJ, Seren L, Paketçi C. The effect of iron deficiency anaemia on plasma thyroid hormone levels in childhood. Turk Arch Ped. 2011; 46:122-5.
- Campbell NR, Hasinoff BB, Stalts H, Rao B, Wong NC. Ferrous sulfate reduces thyroxine efficacy in patients with hypothyroidism. Ann Intern Med. 1992; 117(12):1010-3. [DOI:10.7326/0003-4819-117-12-1010]
- Park SM, Chatterjee VK. Genetics of congenital hypothyroidism. J Medi Genet. 2005; 42(3):379-8. [DOI:10.1136/jmg.2004.024158]
- Nascimento AC, Guedes DR, Santos CS, Knobel M, Rubio IG, Medeiros-Neto G, Thyroperoxidase genemutations in congenital goitrous hypothyroidism with total and partial iodide organification defect. Thyroid. 2003; 13(12):1145-51. [DOI:10.1089/10507250360731550]
- Kimura S, Hong YS, Kotani T, Ohtaki S, Kikkawa F. Structure of the human thyroid peroxidase gene: Comparison and relationship to the human myeloperoxidase gene. Biochem. 1989; 28(10):4481-9. [DOI:10.1021/bi00436a054]
- Holtorf K. Peripheral thyroid hormone conversion and its impact on TSH and metabolic activity. J Restor Med. 2014; 3(1):30-52. [DOI:10.14200/jrm.2014.3.0103]
- Murakawa H, Bland CE, Willis WT, Dallman PR. Iron deficiency and neutrophil function: Different rates of correction of the depressions in oxidative burst and myeloperoxidase activity after iron treatment. Blood. 1987; 69(5):1464-8. [PMID]
- Ackrell BA, Maguire J, Dallman PR, Kearney EB. Effect of iron deficiency on succinate and NADH-ubiquinone oxidoreductases in skeletal muscle mitochondria. J Biol Chem. 1984; 259(16):10053-9. [DOI:10.1515/9783111521350-041]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |