دوره 22، شماره 4 - ( مهر و آبان 1398 )
جلد 22 شماره 4 صفحات 51-40 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Tavakkol Afshari H S, Homayouni Tabrizi M, Ardalan T. Evaluation of Antioxidant and Anticancer Effects of Nanoemulsions Prepared Using Dill Essential Oil. J Arak Uni Med Sci 2019; 22 (4) :40-51
URL: http://jams.arakmu.ac.ir/article-1-6093-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6093-fa.html
توکل افشاری هاله سادات، همایونی تبریزی مسعود، اردلان توران. بررسی خصوصیات آنتیاکسیدانی و ضدسرطانی نانوامولسیون سنتزشده توسط اسانس گیاه شوید. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (4) :40-51
1- گروه زیستشناسی، دانشکده علوم پایه، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران.
2- گروه زیستشناسی، دانشکده علوم پایه، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران. ،mhomayouni6@gmail.com
3- گروه شیمی، دانشکده علوم پایه، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران.
2- گروه زیستشناسی، دانشکده علوم پایه، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران. ،
3- گروه شیمی، دانشکده علوم پایه، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران.
متن کامل [PDF 2757 kb]
(2353 دریافت)
| چکیده (HTML) (3733 مشاهده)
سنجش رادیکالزدایی DPPH
تصویر شماره 2 نشاندهنده فعالیت نانوامولسیون سنتزشده توسط اسانس گیاه شوید در حذف رادیکالهای آزاد DPPH در مقایسه با گلوتاتیون به عنوان کنترل مثبت است. همانطور که ملاحظه میشود نانوامولسیون در حذف رادیکالهای آزاد DPPH به صورت وابسته به غلظت عمل میکند؛ به طوری که با افزایش غلظت نانوامولسیون، فعالیت رادیکالزدایی نیز افزایش مییابد. حدود 50 درصد از رادیکالهای آزاد DPPH، در غلظت حدود 500 میکروگرم بر میلیلیتر نانوامولسیون مهار شدند (IC50=500 µg/ml). در غلظت نهایی 1000 میکروگرم بر میلیلیتر بیش از 65 درصد رادیکالها حذف شدند.
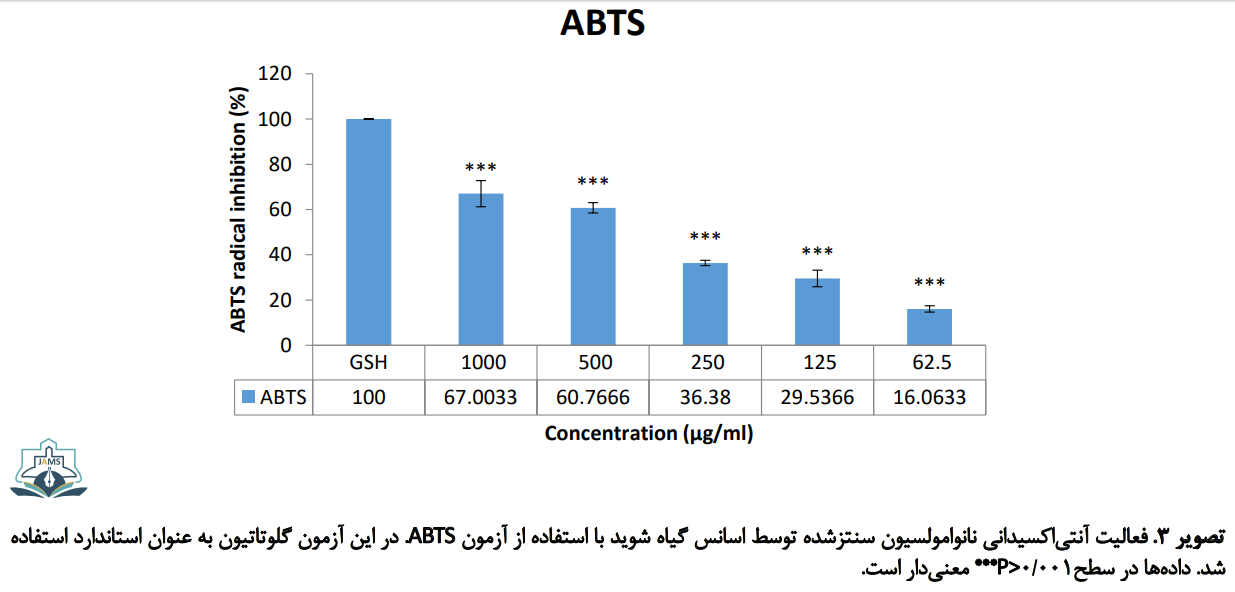
سنجش رادیکالزدایی ABTS
تصویر شماره 3 فعالیت حذف رادیکالهای ABTS نانوامولسیون سنتزشده توسط اسانس گیاه شوید را در مقایسه با گلوتاتیون به عنوان کنترل مثبت نشان میدهد. همان طور که ملاحظه میشود مشابه آزمون پیشین، فعالیت نانوامولسیون در حذف رادیکالهای ABTS به صورت وابسته به غلظت است و با افزایش غلظت، درصد بیشتری از رادیکالها توسط نانوامولسیون حذف میشوند. حدود 50 درصد از رادیکالهای آزاد ABTS، در غلظت حدود 420 میکروگرم بر میلیلیتر نانوامولسیون مهار شدند (IC50=420 µg/ml). نانوامولسیون قادر به حذف بیش از 68 درصد رادیکالها در غلظت نهایی 1000 میکروگرم بر میلیلیتراست.
متن کامل: (3455 مشاهده)
مقدمه
استفاده از فناوری نانو برای درمان سرطان، در سالهای اخیر توجه زیادی را به خود جلب کرده است. این فناوری میتواند روشهای منحصربهفردی را برای پیشبینی، پیشگیری و درمان اولیه سرطان ارائه کند [1].
از آنجاییکه نانوذرات 100 تا 1000 برابر کوچکتر از سلولهای سرطانی هستند، میتوانند بهراحتی از طریق رگهای خونی انتقال یابند و با پروتئینهای اختصاصی تومور در سطح و نیز در داخل سلولهای سرطانی ارتباط برقرار کنند. بنابراین استفاده از آنها به عنوان ناقلین تحویل دارو به سلولهای سرطانی، توجه زیادی را به خود جلب کرده است [2]. داروهای کپسولهشده در نانوذرات هدفمند، پتانسیل بهبود کارایی و ایمنی داروهای موجود را دارند. همچنین در حال حاضر نانوحاملهای چندمنظوره برای کمک به پرتودرمانی و شیمیدرمانی ظهور پیداکردهاند [3]. از بین نانوداروهای تولیدشده، نانوامولسیون یک ابزار مهم در این عرصه است که به منظور کاربرد بالینی و درمانی طراحیشده است [4]. نانوامولسیون درواقع یک سیستم ذرات کلوئیدی است که از دو مایع ناهمگن مانند مخلوط آب و روغن تشکیل میشود [5]. نانوامولسیونها تحت عنوان میکروامولسیون یا امولسیون بسیار ریز نیز شناخته میشوند و اندازهای بین 20 تا 200 نانومتر دارند [6].
در برخی مطالعات نشان داده شده است نانوامولسیونها مزایای بسیاری نسبت به امولسیونهای معمولی دارند، از جمله این مزایا میتوان به شفافیت نوری، پایداری جنبشی بالا و افزایش قابلیت زیستی اشاره کرد [7]. پس از تحقیقات بسیار در بین نانومواد مختلف، نانوامولسیون به عنوان سیستم تحویل دارویی مناسب برای داروهای سمیت لیپوفیلی پیشبینی شده است و میتواند به طور مؤثری جایگزین شیمیدرمانی باشد.
ویژگیهای مناسب نانو امولسیون شامل سازگاری با محیطزیست و قابلتجزیه زیستیبودن، سطح بزرگ، سهولت آمادهسازی و ثبات ترمودینامیک است [4]. از آنجا که میزان اثربخشی درمان سرطان به پتانسیل دارو برای کاهش و ازبینبردن تومورها بدون آسیبرساندن به بافت سالم بستگی دارد، نانوامولسیون به عنوان حامل دارویی هدفمند در این زمینه میتواند مفید واقع شود [8]. همانطور که پیشتر نیز اشاره شد، درباره نانوامولسیونها برای درمان بیماریهایی مانند سرطان و HIV مطالعه شده است [10 ،9].
یک استراتژی امیدوارکننده برای درمان سرطان، تحویل داروهای شیمیدرمانی با حامل دارویی هدفمند به بافت تومور است که با تزریق وریدی داخل شکمی (IA) عرضه میشود و در این راستا استفاده از نانوامولسیونها میتواند مفید واقع شود [12 ،11]. مطالعات نشان است گیاه دارویی شوید دارای پتانسیل ضدسرطانی است و اثرات مفید آن در درمان سرطانهایی از جمله کبد و دهانه رحم گزارش شده است [13]. انتوفوران، ترکیب فعال و جداشده از روغن دانه گیاه شوید، دارای اثرات ضدسرطانی قابلتوجهی در برابر انواع مختلف سرطان است [14].
در ایران از این گیاه به عنوان دارویی برای هیپولیپیدمی استفاده میشود. به علاوه این گیاه دارای اثرات آنتیاکسیدانی است و عملکرد خوبی در مهار رادیکالهای آزاد دارد [15]. دانههای گیاه شوید به طور گسترده در طب سنتی برای درمان یرقان و بیماریهای کبدی استفاده میشوند [14]. امروزه روشهای موجود برای درمان سرطان کبد کافی نیست و از نظر اقتصادی هزینههای بسیار زیادی را به بیماران تحمیل میکند. در مقابل ترکیبات حاصل از گیاهان مقرونبهصرفه و در دسترس و کارایی آنها موردتوجه پژوهشگران قرار گرفته است. حدود 65 درصد بیماران مبتلا به سرطان کبد از درمان گیاهی بدون هیچگونه اثرات مخرب جانبی بهرهمند شدهاند [14].
خواص ضدسرطان گیاهان دارویی به منظور جلوگیری از پیشرفت سرطان و القا آپوپتوز در سلولهای سرطانی در تحقیقات بسیاری بررسی شده است [16]. هدف از این پژوهش بررسی اثرات آنتیاکسیدانی نانوامولسیون سنتزشده توسط اسانس گیاه شوید و همچنین ارزیابی سمیت سلولی آن روی رده HepG2 در محیط in vitro است.
مواد و روشها
تهیه نانوامولسیون
جهت تهیه نانوامولسیون، اسانس شوید از شرکت طبیب دارو کاشان خریداری شد، توئین 20 و توئین 80 از شرکت سیگما خریداری شد و به عنوان امولسیون فایر استفاده شد. همچنین اتیلن گلیکول به عنوان حلال کمکی از شرکت مرک تهیه شد. برای تهیه نانوامولسیون پایدار از امولسیون فایر و اسانس، از امواج ماورای صوت با قدرت 200 وات به مدت 30 دقیقه استفاده شد.
کشت سلول
ردههای سلولی سرطان کبد HepG2)) و اندوتلیال سیاهرگ بند ناف انسان (HUVEC) از پژوهشکده بوعلی مشهد خریداری شد. به منظور کشت سلولهای HepG2 از محیط کشت DMEM (GIBCO, USA) و برای کشت سلولهای HUVEC از محیط کشت RPMI (GIBCO, USA) استفاده شد. جهت فراهمکردن محیط کشت کامل DMEM و RPMI 90 میلیلیتر، 10 میلیلیتر سرم جنینی گاوی (GIBCO, USA) و یک میلیلیتر پنیسیلین / استرپتومایسین (GIBCO, USA) مخلوط شدند. سپس هر دو ردهی سلولی در انکوباتور و دمای 37 درجه سیلسیوس، 5 درصد CO2 و رطوبت 95 درصد نگهداری شدند.
آزمون MTT
آزمون MTT (3- [4و5- دی متیل تیازول- 2- ئیل] -2-5- دیفنیل تترازولیوم برومید) بر اساس تبدیل MTT به بلورهای فورمازان توسط سلولهای زنده است که فعالیتهای میتوکندری را تعیین میکند. از آنجا که برای اکثر جمعیتهای سلولی، فعالیت میتوکندریایی تام با تعداد سلولهای زنده مرتبط است، این آزمایش به طور گستردهای برای اندازهگیری اثرات سمیت داروها روی ردههای سلولی یا سلولهای اولیه بیمار استفاده میشود [17].
در این روش سمیت نانوامولسیون به منظور مقایسه تأثیر آن بر سلولهای سرطانی و نرمال بر رده سلولی سرطان کبد (HepG2) و سلولهای اندوتلیال سیاهرگ بند ناف انسان (HUVEC) بررسی شد. به این منظور از پلیتهای 96خانهای استفاده شد و در هر چاهک آن حدود 5000 سلول کشت داده شد. شمارش سلولها با استفاده از رنگ تریپان بلو و لام هموسایتومتر انجام شد. پس از کشت، پلیت را انکوبه شد و بعد از گذشت 24 ساعت محیط جدید شامل غلظتهای مختلف نانوامولسیون اضافه و انکوباسیون مجدد در زمان 48 ساعت انجام شد. آزمایش برای هرغلظت از نانوامولسیون با سه بار تکرار انجام شد. در مرحله بعد پس از خارجکردن پلیتها از انکوباتور و تخلیه محیط رویی، 20 میکرولیتر محلول MTT درون هر چاهک افزوده شد و پلیتها چهار ساعت تحت انکوباسیون در دمای 37 درجه قرار گرفتند. در مرحله بعد محیط کشت و MTT خارج شد و 100 میکرولیتر DMSO به هریک از چاهکها اضافه شد. DMSO سبب تغییر رنگ کریستالهای فورمازان تولیدشده به محلول بنفشرنگی شد و شدت رنگ ایجادشده به وسیله دستگاه ELISA plate reader درطول موج 570 نانومتر ارزیابی شد. نهایتاً میزان بقای سلولها در هر غلظت به وسیله فرمول شماره 1 محاسبه شد.
1.

در در فرمول شماره 1 کنترل نشانگر میزان جذب نوری فورمازان ایجادشده در شاهد منفی است. درنهایت با رسم یک منحنی دوبعدی درصد بقای سلولها در مقابل غلظت نانوامولسیون مشخص میشود که از این منحنی برای محاسبه IC50 (غلظیتی که 50 درصد سلولها سالم و 50 درصد سلولها مردهاند) استفاده میشود.
ارزیابی ویژگیهای آنتیاکسیدان
روشهای بیشماری برای ارزیابی فعالیتهای آنتیاکسیدانی ترکیبات طبیعی در غذاها یا سیستمهای زیستی وجود دارند. دو رادیکالی که به طور معمول جهت سنجش اثرات آنتیاکسیدانی به صورت آزمایشگاهی استفاده میشوند، تحت عنوان DPPH (1،1- دیفنیل-2- پیکریل- هیدرازیل) و ABTS (2،2-آزینو بیس (3-اتیل بنزوتیازولین 6- سولفونیک اسید)) شناخته میشوند. روش ABTS انعطافپذیری بالایی دارد و میتوان این روش را در pHهای مختلف استفاده کرد (بر خلاف DPPH که به pH اسیدی حساس است). مزیت دیگر روش ABTS نسبت به DPPH این است که ABTS در محلول بافر آبی بهسرعت واکنش میدهد در حالی که DPPH بهآهستگی با نمونهها وارد واکنش میشود. در این پژوهش به منظور ارزیابی فعالیتهای آنتیاکسیدانی نانوامولسیون تولیدشده توسط اسانس گیاه شوید از هر دو آزمون DPPH و ABTS استفاده شد [18].
آزمون DPPH
DPPH (1،1- دیفنیل-2- پیکریل- هیدرازیل)، نوعی روش سنجش خاصیت آنتیاکسیدانی بر مبنای انتقال الکترون است که در آن محلولی بنفشرنگ در اتانول تولید میشود و در طول موج 517 نانومتر حداکثر جذب را دارد. این رادیکال که در دمای اتاق پایدار است در حضور یک مولکول آنتیاکسیدان کاهش مییابد و باعث ایجاد محلول اتانول بیرنگ و کاهش جذب در طول موج 517 نانومتر میشود [19].
جهت انجام این آزمون پودر DPPH از شرکت Sigma-Aldrich, USA تهیه شد. ابتدا محلول DPPH 1/0 میلیمولار در اتانول 95 درصد آماده شد و در مرحله بعد با نسبت مساوی با نانوامولسیون سنتزشده توسط اسانس گیاه شوید و ترکیب آنتیاکسیدان استاندارد مدنظر تحت عنوان گلوتاتیون احیامخلوط شد. پس از 30 دقیقه، جذب نمونهها در طول موج 517 نانومتر خوانده شد. به منظور محاسبه غلظت لازم جهت مهار50 درصد فعالیت آنتیاکسیدانی (IC50) برای نانوامولسیون و گلوتاتیون احیا (GSH)، آزمایش در شش غلظت مختلف (31/25، 62/5، 125، 250، 500 و 1000 میکروگرم بر میلیلیتر) ازاین دو ماده انجام شد. هر آزمایش در سه تکرار انجام شد و از مقادیر میانگین حاصل جهت محاسبات استفاده شد. درصد مهار رادیکال DPPH به وسیله فرمول شماره 2 به دست آمد:
2.

آزمون ABTS
رادیکال ABTS (2،2-آزینو بیس (3-اتیل بنزوتیازولین 6- سولفونیک اسید)) به وسیله اکسیداسیون ABTS توسط پتاسیم پر سولفات ایجاد میشود و در حضور ترکیبات آنتیاکسیدان کاهش مییابد [20]. به منظور انجام این آزمون پودر ABTS از شرکت Sigma-Aldrich, USA تهیه شد. جهت آمادهسازی محلول رادیکال ABTS، ابتدا ABTS هفت میلیمولار (ml 2) و پتاسیم پرسولفات 2/45 میلی مولار (1 ml) جهت اکسیداسیون ABTS توسط پتاسیم پرسولفات با یکدیگر مخلوط شدند و سپس محلول حاصل به مدت 16 ساعت در تاریکی و دمای 25 درجه سیلسیوس قرار داده شد. در مرحله بعد محلول رادیکالی رقیق شد و با نسبت یکبهیک با نانوامولسیون و گلوتاتیون احیا (GSH) به عنوان آنتیاکسیدان استاندارد در غلظتهای مختلف (31/25، 62/5، 125، 250، 500 و 1000 میکروگرم بر میلیلیتر) مخلوط و در دمای 37 درجه سیلسیوس در تاریکی انکوبه شد. پس از گذشت یک ساعت، جذب آنها در طول موج 734 نانومتر سنجیده شد. جهت بهدستآوردن IC50 آزمایش در شش غلظت مختلف از نانوامولسیون وگلوتاتیون احیا (GSH) انجام شد. هر آزمایش در سه تکرار انجام شد و مقادیر میانگین حاصل برای محاسبات به کار رفت. درصد مهار رادیکال ABTS به وسیله فرمول شماره 3 محاسبه شد:
3.

آنالیز آماری
جهت ارزیابی میزان بقای سلولهای تیمارشده و خاصیت آنتیاکسیدانی نانوامولسیون اسانس گیاه شوید از نسخه 22 نرمافزار SPSS استفاده شد. تحلیل واریانس یکطرفه و مقایسه میانگینها با روشLSD انجام شد.
یافتهها
سنجش سمیت سلولی القاشده توسط نانوامولسیون سنتزشده با استفاده از اسانس گیاه شوید بر سلولهای ردههای سلولی سرطان کبدو اندوتلیال سیاهرگ بند ناف انسان
تصویر شماره 1 نشاندهنده سمیت سلولی نانوامولسیون سنتزشده توسط اسانس گیاه شوید علیه سلولهای سرطان کبد HepG2)) و سلولهای اندوتلیال سیاهرگ بند ناف انسان (HUVEC) است. همانطور که ملاحظه میشود، نانوامولسیون بر هر دو رده سلولی سمیت کمی را اعمال کرده است. میزان بقای هر دو رده سلولی در غلظت 50 میکروگرم بر میلیلیتر به طور معنیداری کاهش یافته است. سمیت با افزایش غلظت افزایش مییابد، در نتیجه نانوامولسیون بقای سلولها را به صورت وابسته به دُز کاهش میدهد. سمیت اعمالشده بر سلولهای سرطانی از سلولهای نرمال بیشتر است.
استفاده از فناوری نانو برای درمان سرطان، در سالهای اخیر توجه زیادی را به خود جلب کرده است. این فناوری میتواند روشهای منحصربهفردی را برای پیشبینی، پیشگیری و درمان اولیه سرطان ارائه کند [1].
از آنجاییکه نانوذرات 100 تا 1000 برابر کوچکتر از سلولهای سرطانی هستند، میتوانند بهراحتی از طریق رگهای خونی انتقال یابند و با پروتئینهای اختصاصی تومور در سطح و نیز در داخل سلولهای سرطانی ارتباط برقرار کنند. بنابراین استفاده از آنها به عنوان ناقلین تحویل دارو به سلولهای سرطانی، توجه زیادی را به خود جلب کرده است [2]. داروهای کپسولهشده در نانوذرات هدفمند، پتانسیل بهبود کارایی و ایمنی داروهای موجود را دارند. همچنین در حال حاضر نانوحاملهای چندمنظوره برای کمک به پرتودرمانی و شیمیدرمانی ظهور پیداکردهاند [3]. از بین نانوداروهای تولیدشده، نانوامولسیون یک ابزار مهم در این عرصه است که به منظور کاربرد بالینی و درمانی طراحیشده است [4]. نانوامولسیون درواقع یک سیستم ذرات کلوئیدی است که از دو مایع ناهمگن مانند مخلوط آب و روغن تشکیل میشود [5]. نانوامولسیونها تحت عنوان میکروامولسیون یا امولسیون بسیار ریز نیز شناخته میشوند و اندازهای بین 20 تا 200 نانومتر دارند [6].
در برخی مطالعات نشان داده شده است نانوامولسیونها مزایای بسیاری نسبت به امولسیونهای معمولی دارند، از جمله این مزایا میتوان به شفافیت نوری، پایداری جنبشی بالا و افزایش قابلیت زیستی اشاره کرد [7]. پس از تحقیقات بسیار در بین نانومواد مختلف، نانوامولسیون به عنوان سیستم تحویل دارویی مناسب برای داروهای سمیت لیپوفیلی پیشبینی شده است و میتواند به طور مؤثری جایگزین شیمیدرمانی باشد.
ویژگیهای مناسب نانو امولسیون شامل سازگاری با محیطزیست و قابلتجزیه زیستیبودن، سطح بزرگ، سهولت آمادهسازی و ثبات ترمودینامیک است [4]. از آنجا که میزان اثربخشی درمان سرطان به پتانسیل دارو برای کاهش و ازبینبردن تومورها بدون آسیبرساندن به بافت سالم بستگی دارد، نانوامولسیون به عنوان حامل دارویی هدفمند در این زمینه میتواند مفید واقع شود [8]. همانطور که پیشتر نیز اشاره شد، درباره نانوامولسیونها برای درمان بیماریهایی مانند سرطان و HIV مطالعه شده است [10 ،9].
یک استراتژی امیدوارکننده برای درمان سرطان، تحویل داروهای شیمیدرمانی با حامل دارویی هدفمند به بافت تومور است که با تزریق وریدی داخل شکمی (IA) عرضه میشود و در این راستا استفاده از نانوامولسیونها میتواند مفید واقع شود [12 ،11]. مطالعات نشان است گیاه دارویی شوید دارای پتانسیل ضدسرطانی است و اثرات مفید آن در درمان سرطانهایی از جمله کبد و دهانه رحم گزارش شده است [13]. انتوفوران، ترکیب فعال و جداشده از روغن دانه گیاه شوید، دارای اثرات ضدسرطانی قابلتوجهی در برابر انواع مختلف سرطان است [14].
در ایران از این گیاه به عنوان دارویی برای هیپولیپیدمی استفاده میشود. به علاوه این گیاه دارای اثرات آنتیاکسیدانی است و عملکرد خوبی در مهار رادیکالهای آزاد دارد [15]. دانههای گیاه شوید به طور گسترده در طب سنتی برای درمان یرقان و بیماریهای کبدی استفاده میشوند [14]. امروزه روشهای موجود برای درمان سرطان کبد کافی نیست و از نظر اقتصادی هزینههای بسیار زیادی را به بیماران تحمیل میکند. در مقابل ترکیبات حاصل از گیاهان مقرونبهصرفه و در دسترس و کارایی آنها موردتوجه پژوهشگران قرار گرفته است. حدود 65 درصد بیماران مبتلا به سرطان کبد از درمان گیاهی بدون هیچگونه اثرات مخرب جانبی بهرهمند شدهاند [14].
خواص ضدسرطان گیاهان دارویی به منظور جلوگیری از پیشرفت سرطان و القا آپوپتوز در سلولهای سرطانی در تحقیقات بسیاری بررسی شده است [16]. هدف از این پژوهش بررسی اثرات آنتیاکسیدانی نانوامولسیون سنتزشده توسط اسانس گیاه شوید و همچنین ارزیابی سمیت سلولی آن روی رده HepG2 در محیط in vitro است.
مواد و روشها
تهیه نانوامولسیون
جهت تهیه نانوامولسیون، اسانس شوید از شرکت طبیب دارو کاشان خریداری شد، توئین 20 و توئین 80 از شرکت سیگما خریداری شد و به عنوان امولسیون فایر استفاده شد. همچنین اتیلن گلیکول به عنوان حلال کمکی از شرکت مرک تهیه شد. برای تهیه نانوامولسیون پایدار از امولسیون فایر و اسانس، از امواج ماورای صوت با قدرت 200 وات به مدت 30 دقیقه استفاده شد.
کشت سلول
ردههای سلولی سرطان کبد HepG2)) و اندوتلیال سیاهرگ بند ناف انسان (HUVEC) از پژوهشکده بوعلی مشهد خریداری شد. به منظور کشت سلولهای HepG2 از محیط کشت DMEM (GIBCO, USA) و برای کشت سلولهای HUVEC از محیط کشت RPMI (GIBCO, USA) استفاده شد. جهت فراهمکردن محیط کشت کامل DMEM و RPMI 90 میلیلیتر، 10 میلیلیتر سرم جنینی گاوی (GIBCO, USA) و یک میلیلیتر پنیسیلین / استرپتومایسین (GIBCO, USA) مخلوط شدند. سپس هر دو ردهی سلولی در انکوباتور و دمای 37 درجه سیلسیوس، 5 درصد CO2 و رطوبت 95 درصد نگهداری شدند.
آزمون MTT
آزمون MTT (3- [4و5- دی متیل تیازول- 2- ئیل] -2-5- دیفنیل تترازولیوم برومید) بر اساس تبدیل MTT به بلورهای فورمازان توسط سلولهای زنده است که فعالیتهای میتوکندری را تعیین میکند. از آنجا که برای اکثر جمعیتهای سلولی، فعالیت میتوکندریایی تام با تعداد سلولهای زنده مرتبط است، این آزمایش به طور گستردهای برای اندازهگیری اثرات سمیت داروها روی ردههای سلولی یا سلولهای اولیه بیمار استفاده میشود [17].
در این روش سمیت نانوامولسیون به منظور مقایسه تأثیر آن بر سلولهای سرطانی و نرمال بر رده سلولی سرطان کبد (HepG2) و سلولهای اندوتلیال سیاهرگ بند ناف انسان (HUVEC) بررسی شد. به این منظور از پلیتهای 96خانهای استفاده شد و در هر چاهک آن حدود 5000 سلول کشت داده شد. شمارش سلولها با استفاده از رنگ تریپان بلو و لام هموسایتومتر انجام شد. پس از کشت، پلیت را انکوبه شد و بعد از گذشت 24 ساعت محیط جدید شامل غلظتهای مختلف نانوامولسیون اضافه و انکوباسیون مجدد در زمان 48 ساعت انجام شد. آزمایش برای هرغلظت از نانوامولسیون با سه بار تکرار انجام شد. در مرحله بعد پس از خارجکردن پلیتها از انکوباتور و تخلیه محیط رویی، 20 میکرولیتر محلول MTT درون هر چاهک افزوده شد و پلیتها چهار ساعت تحت انکوباسیون در دمای 37 درجه قرار گرفتند. در مرحله بعد محیط کشت و MTT خارج شد و 100 میکرولیتر DMSO به هریک از چاهکها اضافه شد. DMSO سبب تغییر رنگ کریستالهای فورمازان تولیدشده به محلول بنفشرنگی شد و شدت رنگ ایجادشده به وسیله دستگاه ELISA plate reader درطول موج 570 نانومتر ارزیابی شد. نهایتاً میزان بقای سلولها در هر غلظت به وسیله فرمول شماره 1 محاسبه شد.
1.

در در فرمول شماره 1 کنترل نشانگر میزان جذب نوری فورمازان ایجادشده در شاهد منفی است. درنهایت با رسم یک منحنی دوبعدی درصد بقای سلولها در مقابل غلظت نانوامولسیون مشخص میشود که از این منحنی برای محاسبه IC50 (غلظیتی که 50 درصد سلولها سالم و 50 درصد سلولها مردهاند) استفاده میشود.
ارزیابی ویژگیهای آنتیاکسیدان
روشهای بیشماری برای ارزیابی فعالیتهای آنتیاکسیدانی ترکیبات طبیعی در غذاها یا سیستمهای زیستی وجود دارند. دو رادیکالی که به طور معمول جهت سنجش اثرات آنتیاکسیدانی به صورت آزمایشگاهی استفاده میشوند، تحت عنوان DPPH (1،1- دیفنیل-2- پیکریل- هیدرازیل) و ABTS (2،2-آزینو بیس (3-اتیل بنزوتیازولین 6- سولفونیک اسید)) شناخته میشوند. روش ABTS انعطافپذیری بالایی دارد و میتوان این روش را در pHهای مختلف استفاده کرد (بر خلاف DPPH که به pH اسیدی حساس است). مزیت دیگر روش ABTS نسبت به DPPH این است که ABTS در محلول بافر آبی بهسرعت واکنش میدهد در حالی که DPPH بهآهستگی با نمونهها وارد واکنش میشود. در این پژوهش به منظور ارزیابی فعالیتهای آنتیاکسیدانی نانوامولسیون تولیدشده توسط اسانس گیاه شوید از هر دو آزمون DPPH و ABTS استفاده شد [18].
آزمون DPPH
DPPH (1،1- دیفنیل-2- پیکریل- هیدرازیل)، نوعی روش سنجش خاصیت آنتیاکسیدانی بر مبنای انتقال الکترون است که در آن محلولی بنفشرنگ در اتانول تولید میشود و در طول موج 517 نانومتر حداکثر جذب را دارد. این رادیکال که در دمای اتاق پایدار است در حضور یک مولکول آنتیاکسیدان کاهش مییابد و باعث ایجاد محلول اتانول بیرنگ و کاهش جذب در طول موج 517 نانومتر میشود [19].
جهت انجام این آزمون پودر DPPH از شرکت Sigma-Aldrich, USA تهیه شد. ابتدا محلول DPPH 1/0 میلیمولار در اتانول 95 درصد آماده شد و در مرحله بعد با نسبت مساوی با نانوامولسیون سنتزشده توسط اسانس گیاه شوید و ترکیب آنتیاکسیدان استاندارد مدنظر تحت عنوان گلوتاتیون احیامخلوط شد. پس از 30 دقیقه، جذب نمونهها در طول موج 517 نانومتر خوانده شد. به منظور محاسبه غلظت لازم جهت مهار50 درصد فعالیت آنتیاکسیدانی (IC50) برای نانوامولسیون و گلوتاتیون احیا (GSH)، آزمایش در شش غلظت مختلف (31/25، 62/5، 125، 250، 500 و 1000 میکروگرم بر میلیلیتر) ازاین دو ماده انجام شد. هر آزمایش در سه تکرار انجام شد و از مقادیر میانگین حاصل جهت محاسبات استفاده شد. درصد مهار رادیکال DPPH به وسیله فرمول شماره 2 به دست آمد:
2.

آزمون ABTS
رادیکال ABTS (2،2-آزینو بیس (3-اتیل بنزوتیازولین 6- سولفونیک اسید)) به وسیله اکسیداسیون ABTS توسط پتاسیم پر سولفات ایجاد میشود و در حضور ترکیبات آنتیاکسیدان کاهش مییابد [20]. به منظور انجام این آزمون پودر ABTS از شرکت Sigma-Aldrich, USA تهیه شد. جهت آمادهسازی محلول رادیکال ABTS، ابتدا ABTS هفت میلیمولار (ml 2) و پتاسیم پرسولفات 2/45 میلی مولار (1 ml) جهت اکسیداسیون ABTS توسط پتاسیم پرسولفات با یکدیگر مخلوط شدند و سپس محلول حاصل به مدت 16 ساعت در تاریکی و دمای 25 درجه سیلسیوس قرار داده شد. در مرحله بعد محلول رادیکالی رقیق شد و با نسبت یکبهیک با نانوامولسیون و گلوتاتیون احیا (GSH) به عنوان آنتیاکسیدان استاندارد در غلظتهای مختلف (31/25، 62/5، 125، 250، 500 و 1000 میکروگرم بر میلیلیتر) مخلوط و در دمای 37 درجه سیلسیوس در تاریکی انکوبه شد. پس از گذشت یک ساعت، جذب آنها در طول موج 734 نانومتر سنجیده شد. جهت بهدستآوردن IC50 آزمایش در شش غلظت مختلف از نانوامولسیون وگلوتاتیون احیا (GSH) انجام شد. هر آزمایش در سه تکرار انجام شد و مقادیر میانگین حاصل برای محاسبات به کار رفت. درصد مهار رادیکال ABTS به وسیله فرمول شماره 3 محاسبه شد:
3.

آنالیز آماری
جهت ارزیابی میزان بقای سلولهای تیمارشده و خاصیت آنتیاکسیدانی نانوامولسیون اسانس گیاه شوید از نسخه 22 نرمافزار SPSS استفاده شد. تحلیل واریانس یکطرفه و مقایسه میانگینها با روشLSD انجام شد.
یافتهها
سنجش سمیت سلولی القاشده توسط نانوامولسیون سنتزشده با استفاده از اسانس گیاه شوید بر سلولهای ردههای سلولی سرطان کبدو اندوتلیال سیاهرگ بند ناف انسان
تصویر شماره 1 نشاندهنده سمیت سلولی نانوامولسیون سنتزشده توسط اسانس گیاه شوید علیه سلولهای سرطان کبد HepG2)) و سلولهای اندوتلیال سیاهرگ بند ناف انسان (HUVEC) است. همانطور که ملاحظه میشود، نانوامولسیون بر هر دو رده سلولی سمیت کمی را اعمال کرده است. میزان بقای هر دو رده سلولی در غلظت 50 میکروگرم بر میلیلیتر به طور معنیداری کاهش یافته است. سمیت با افزایش غلظت افزایش مییابد، در نتیجه نانوامولسیون بقای سلولها را به صورت وابسته به دُز کاهش میدهد. سمیت اعمالشده بر سلولهای سرطانی از سلولهای نرمال بیشتر است.
سنجش رادیکالزدایی DPPH
تصویر شماره 2 نشاندهنده فعالیت نانوامولسیون سنتزشده توسط اسانس گیاه شوید در حذف رادیکالهای آزاد DPPH در مقایسه با گلوتاتیون به عنوان کنترل مثبت است. همانطور که ملاحظه میشود نانوامولسیون در حذف رادیکالهای آزاد DPPH به صورت وابسته به غلظت عمل میکند؛ به طوری که با افزایش غلظت نانوامولسیون، فعالیت رادیکالزدایی نیز افزایش مییابد. حدود 50 درصد از رادیکالهای آزاد DPPH، در غلظت حدود 500 میکروگرم بر میلیلیتر نانوامولسیون مهار شدند (IC50=500 µg/ml). در غلظت نهایی 1000 میکروگرم بر میلیلیتر بیش از 65 درصد رادیکالها حذف شدند.
سنجش رادیکالزدایی ABTS
تصویر شماره 3 فعالیت حذف رادیکالهای ABTS نانوامولسیون سنتزشده توسط اسانس گیاه شوید را در مقایسه با گلوتاتیون به عنوان کنترل مثبت نشان میدهد. همان طور که ملاحظه میشود مشابه آزمون پیشین، فعالیت نانوامولسیون در حذف رادیکالهای ABTS به صورت وابسته به غلظت است و با افزایش غلظت، درصد بیشتری از رادیکالها توسط نانوامولسیون حذف میشوند. حدود 50 درصد از رادیکالهای آزاد ABTS، در غلظت حدود 420 میکروگرم بر میلیلیتر نانوامولسیون مهار شدند (IC50=420 µg/ml). نانوامولسیون قادر به حذف بیش از 68 درصد رادیکالها در غلظت نهایی 1000 میکروگرم بر میلیلیتراست.
بحث
در مطالعه حاضر، اثرات آنتیاکسیدانی و سمیت سلولی نانوامولسیون سنتزشده توسط اسانس گیاه شوید بررسی شد. نتایج حاصل از این تحقیق نشان داد با افزایش غلظت نانوامولسیون سنتزشده از اسانس گیاه شوید، درصد مهار رادیکالهای آزاد ABST و DPPH به طور مؤثری مشابه گلوتاتیون (به عنوان کنترل مثبت) افزایش داشت. به گونهای که حدود 50 درصد از رادیکالهای آزاد ABTS، در غلظت 420 میکروگرم بر میلیلیتر و نیمی از رادیکالهای آزاد DPPH، در غلظت 500 میکروگرم بر میلیلیتر از نانوامولسیون مهار شدند. همچنین نتایج حاصل از آزمون MTT روی رده سرطانی HepG2 و رده نرمال HUVEC نشان داد میزان بقای سلولها در غلظت 50 میکروگرم بر میلیلیتر به ترتیب 21/73 و 77/86 میکروگرم بر میلیلیتر است. با افزایش غلظت نانوامولسیون، به طور معنیداری زیستایی سلولها کاهش داشت و سمیت نانوامولسیون سنتزشده توسط اسانس گیاه شوید در سلولهای سرطانی نسبت به نرمال بیشتر بود. همانند اکثر مطالعات ذکرشده، نانوامولسیون مذکور دارای پتانسیل رادیکالزدایی بود و موجب حذف رادیکالهای آزاد DPPH و ABTS شد. به علاوه کاهش معنیداری در بقای سلولها در غلظت 50 میکروگرم بر میلیلیتر مشاهده شد.
اخیراً، استراتژیهای جدید درمانی مبتنی بر فناوری نانو به عنوان جایگزینی برای شیمیدرمانی ظهور پیدا کردهاند. از بین انواع مختلف محصولات نانو، نانوامولسیونها دارای مزایای متعددی برای داروهای ضدسرطان هستند و به کمک آنها میتوان غلظت داخل سلولی داروها را افزایش و درنتیجه سمیت سلولی شیمیدرمانی را کاهش داد [21]. مطالعات مختلف نشان میدهد گیاه شوید دارای ترکیبات مختلفی مانند کاروون، لیمونن و فلاندرن است که ویژگیهای آنتیاکسیدانی و سمیت سلولی این گیاه را میتوان به وجود آنها نسبت داد [22]. ترکیب اصلی گیاه شوید کاروون است که یک ترکیب شیمیایی بالقوه برای حفاظت در برابر سرطان محسوب میشود [23]. مطالعات اخیر گزارش دادند کاروون با فعالکردن P53 و کاسپازها در سلولهای سرطانی مختلف، آپوپتوز را القا میکند.
در مطالعهای مشابه که توسط مقدسی و همکاران صورت گرفت، برای تهیه نانوامولسیون از کورکومین استفاده شد که یکی از ترکیبات مهم پلیفنولیک است. Nano-CUR در روغن فلفل سیاه به عنوان فاز روغنی و Tween 80 به عنوان سورفکتانت آماده شد، سپس خواص آنتیاکسیدان و سمیت آن به کمک آزمونهای DPPH و MTT سنجیده شد. Nano-CUR فعالیت بسیار خوبی را در حذف رادیکالهای آزاد DPPH نشان داد و حدود درصد رادیکالهای آزاد را مهار کرد. اما هیچگونه اثر سمیتی علیه سلولهای Neuro2A تیمارشده با Nano-CUR مشاهده نشد [24].
در تحقیقی اثرات آنتیاکسیدانی نانوامولسیون تهیهشده از گیاه دست بودا با ارزیابی مهار رادیکالهای DPPH بررسی شد. فعالیت آنتیاکسیدانی وابسته به غلظت بود و در غلظت 0/12میکروگرم بر میلیلیتر فعالیت رادیکالزدایی نانوامولسیون در آزمون DPPH 51/6 درصد گزارش شد که به طور معنیداری از فعالیت رادیکالزدایی روغن خالص (30/5درصد) بیشتر بود. همچنین در غلظت 0/06 میکروگرم بر میلیلیتر فعالیت رادیکالزدایی نانوامولسیون در آزمون هیدروکسیل 35/7 درصد گزارش شد که به طور معنیداری از فعالیت رادیکالزدایی روغن خالص (9/6 درصد) بیشتر [25] و مشابه نتایج این پژوهش بود.
در مطالعهای دیگر ویژگیهای آنتیاکسیدانی گیاه شوید به وسیله آزمونهای DPPH، DMPD، FRAP و PRAP بررسی شد. در این پژوهش مشخص شد گیاه شوید را میتوان به عنوان یک آنتیاکسیدان بالقوه استفاده کرد [26]. به علاوه در تحقیقی فعالیت آنتیاکسیدان اسانس گیاه شوید با آزمون DPPH ارزیابی شد و بالاترین میزان مهار رادیکالهای آزاد DPPH 62/79 درصد گزارش شد [27].
در پژوهش دیگری اثرات ضدسرطان نانوامولسیون تهیهشده با استفاده از گیاه سیاهدانه به کمک آزمون MTT علیه رده سلولی سرطانی MCF-7 بررسی شد. کاهش قابل توجه بقای سلولهای سرطانی نشان داد نانوامولسیون بهراحتی به غشای سلولی نفوذ میکند و باعث مرگ سلول میشود. مقدار IC50 پس از 48 ساعت تیمار با نانوامولسیون 4/5±59 میکروگرم بر میلیلیترگزارش شد [28].
در مطالعه دیگری اثرات سمیت سلولی نانوامولسیون تولیدشده با استفاده از گیاه چریش که نوعی گیاه دارویی است، ارزیابی شد. نانوامولسیون مذکور در غلظتهای پایین (1-0/7 μg/mL) علیه سلولهای لنفوسیت انسانی غیرسمی گزارش شد، اما در غلظتهای بالاتر (2-1/2 μg/mL) سمیت علیه این سلولها مشاهده شد [29]. اما در این پژوهش نانوامولسیون در بالاترین غلظت روی سلولهای سرطانی کبد سمیت کمی از خود نشان داد.
علاوه بر مطالعات فوق، در پژوهشی خواص ضدسرطان گیاه دارویی شوید ارزیابی شد. برای این منظور از آزمون MTT و رده سلولی سرطان کبد (HCC) استفاده شد. جهت بررسی تغییرات مورفولوژیکی، رنگآمیزی اکریدین اورنج / اتیدیوم بروماید استفاده شد و فعالیت پروآپوپتوزی با سنجش Annexin-V-FITC / PI و تغییرات چرخه سلولی بررسی شد. در مطالعه مذکور گیاه شوید بقای سلولهای سرطانی را به صورت وابسته به غلظت کاهش داد و همچنین تغییرات مورفولوژیکی مانند جوانهزنی غشای سلولی و تراکم هستهای نمایان شد که نشان از وقوع آپوپتوز داشت. سپس سنجش Annexin-V-FITC / PI و تغییرات چرخه سلولی رویداد آپوپتوز را اثبات کرد [13].
در مطالعهای که روی موشهایی با کلسترول بالا صورت گرفت مشخص شد مصرف عصاره شوید در دُز 500 میلیگرم در روز به مدت 30 روز سطح لیپید سرمی و پراکسیداسیون لیپیدی در کبد را کاهش میدهد [30]. با توجه به نتایج این تحقیق و انجام مطالعات بیشتر روی سایر سلو لها و انجام آزمایشات بیشتر در محیط in vivo میتوان از دُزهای مناسب این ترکیب برای اهداف زیست پزشکی بهره جست.
نتیجهگیری
در پژوهشی که انجام شد، نانوامولسیون سنتزشده توسط اسانس گیاه شوید دارای فعالیت آنتیاکسیدانی قوی بود. این خاصیت نشانگر پتانسیل تبدیلشدن این نانوامولسیون به یک استراتژی درمانی برای بیماریهای ناشی از استرس اکسیداتیو و سرطان در آینده است. پیشنهاد میشود به منظور بررسی سمیت مؤثر روی سایر ردههای سلولهای سرطانی نیز مطالعه صورت گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
تمامی آزمایشهای این تحقیق با رعایت موازین اخلاقی و طبق تأیید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی با شناسه مصوبه IR.IAU.MSHD.REC.1398.027 انجام شد.
حامی مالی
این تحقیق هیچ کمک مالی خاصی از سازمانهای تأمین مالی در بخشهای دولتی، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
مفهومسازی: مسعود همایونی تبریزی؛ روششناسی: مسعود همایونی تبریزی، توران اردلان؛ اعتبارسنجی: مسعود همایونی تبریزی، توران اردلان تحلیل، تحقیق و بررسی: هاله توکل افشار؛ منابع: هاله توکل افشار؛ نگارش پیشنویس: هاله توکل افشار؛ ویراستاری و نهاییسازی نوشته: مسعود همایونی تبریزی، توران اردلان؛ بصریسازی، نظارت، مدیریت پروژه، تأمین مالی: مسعود همایونی تبریزی
تعارض منافع
طبق نظر نویسندگان این مقاله هیچگونه تعارض منافعی ندارد.
در مطالعه حاضر، اثرات آنتیاکسیدانی و سمیت سلولی نانوامولسیون سنتزشده توسط اسانس گیاه شوید بررسی شد. نتایج حاصل از این تحقیق نشان داد با افزایش غلظت نانوامولسیون سنتزشده از اسانس گیاه شوید، درصد مهار رادیکالهای آزاد ABST و DPPH به طور مؤثری مشابه گلوتاتیون (به عنوان کنترل مثبت) افزایش داشت. به گونهای که حدود 50 درصد از رادیکالهای آزاد ABTS، در غلظت 420 میکروگرم بر میلیلیتر و نیمی از رادیکالهای آزاد DPPH، در غلظت 500 میکروگرم بر میلیلیتر از نانوامولسیون مهار شدند. همچنین نتایج حاصل از آزمون MTT روی رده سرطانی HepG2 و رده نرمال HUVEC نشان داد میزان بقای سلولها در غلظت 50 میکروگرم بر میلیلیتر به ترتیب 21/73 و 77/86 میکروگرم بر میلیلیتر است. با افزایش غلظت نانوامولسیون، به طور معنیداری زیستایی سلولها کاهش داشت و سمیت نانوامولسیون سنتزشده توسط اسانس گیاه شوید در سلولهای سرطانی نسبت به نرمال بیشتر بود. همانند اکثر مطالعات ذکرشده، نانوامولسیون مذکور دارای پتانسیل رادیکالزدایی بود و موجب حذف رادیکالهای آزاد DPPH و ABTS شد. به علاوه کاهش معنیداری در بقای سلولها در غلظت 50 میکروگرم بر میلیلیتر مشاهده شد.
اخیراً، استراتژیهای جدید درمانی مبتنی بر فناوری نانو به عنوان جایگزینی برای شیمیدرمانی ظهور پیدا کردهاند. از بین انواع مختلف محصولات نانو، نانوامولسیونها دارای مزایای متعددی برای داروهای ضدسرطان هستند و به کمک آنها میتوان غلظت داخل سلولی داروها را افزایش و درنتیجه سمیت سلولی شیمیدرمانی را کاهش داد [21]. مطالعات مختلف نشان میدهد گیاه شوید دارای ترکیبات مختلفی مانند کاروون، لیمونن و فلاندرن است که ویژگیهای آنتیاکسیدانی و سمیت سلولی این گیاه را میتوان به وجود آنها نسبت داد [22]. ترکیب اصلی گیاه شوید کاروون است که یک ترکیب شیمیایی بالقوه برای حفاظت در برابر سرطان محسوب میشود [23]. مطالعات اخیر گزارش دادند کاروون با فعالکردن P53 و کاسپازها در سلولهای سرطانی مختلف، آپوپتوز را القا میکند.
در مطالعهای مشابه که توسط مقدسی و همکاران صورت گرفت، برای تهیه نانوامولسیون از کورکومین استفاده شد که یکی از ترکیبات مهم پلیفنولیک است. Nano-CUR در روغن فلفل سیاه به عنوان فاز روغنی و Tween 80 به عنوان سورفکتانت آماده شد، سپس خواص آنتیاکسیدان و سمیت آن به کمک آزمونهای DPPH و MTT سنجیده شد. Nano-CUR فعالیت بسیار خوبی را در حذف رادیکالهای آزاد DPPH نشان داد و حدود درصد رادیکالهای آزاد را مهار کرد. اما هیچگونه اثر سمیتی علیه سلولهای Neuro2A تیمارشده با Nano-CUR مشاهده نشد [24].
در تحقیقی اثرات آنتیاکسیدانی نانوامولسیون تهیهشده از گیاه دست بودا با ارزیابی مهار رادیکالهای DPPH بررسی شد. فعالیت آنتیاکسیدانی وابسته به غلظت بود و در غلظت 0/12میکروگرم بر میلیلیتر فعالیت رادیکالزدایی نانوامولسیون در آزمون DPPH 51/6 درصد گزارش شد که به طور معنیداری از فعالیت رادیکالزدایی روغن خالص (30/5درصد) بیشتر بود. همچنین در غلظت 0/06 میکروگرم بر میلیلیتر فعالیت رادیکالزدایی نانوامولسیون در آزمون هیدروکسیل 35/7 درصد گزارش شد که به طور معنیداری از فعالیت رادیکالزدایی روغن خالص (9/6 درصد) بیشتر [25] و مشابه نتایج این پژوهش بود.
در مطالعهای دیگر ویژگیهای آنتیاکسیدانی گیاه شوید به وسیله آزمونهای DPPH، DMPD، FRAP و PRAP بررسی شد. در این پژوهش مشخص شد گیاه شوید را میتوان به عنوان یک آنتیاکسیدان بالقوه استفاده کرد [26]. به علاوه در تحقیقی فعالیت آنتیاکسیدان اسانس گیاه شوید با آزمون DPPH ارزیابی شد و بالاترین میزان مهار رادیکالهای آزاد DPPH 62/79 درصد گزارش شد [27].
در پژوهش دیگری اثرات ضدسرطان نانوامولسیون تهیهشده با استفاده از گیاه سیاهدانه به کمک آزمون MTT علیه رده سلولی سرطانی MCF-7 بررسی شد. کاهش قابل توجه بقای سلولهای سرطانی نشان داد نانوامولسیون بهراحتی به غشای سلولی نفوذ میکند و باعث مرگ سلول میشود. مقدار IC50 پس از 48 ساعت تیمار با نانوامولسیون 4/5±59 میکروگرم بر میلیلیترگزارش شد [28].
در مطالعه دیگری اثرات سمیت سلولی نانوامولسیون تولیدشده با استفاده از گیاه چریش که نوعی گیاه دارویی است، ارزیابی شد. نانوامولسیون مذکور در غلظتهای پایین (1-0/7 μg/mL) علیه سلولهای لنفوسیت انسانی غیرسمی گزارش شد، اما در غلظتهای بالاتر (2-1/2 μg/mL) سمیت علیه این سلولها مشاهده شد [29]. اما در این پژوهش نانوامولسیون در بالاترین غلظت روی سلولهای سرطانی کبد سمیت کمی از خود نشان داد.
علاوه بر مطالعات فوق، در پژوهشی خواص ضدسرطان گیاه دارویی شوید ارزیابی شد. برای این منظور از آزمون MTT و رده سلولی سرطان کبد (HCC) استفاده شد. جهت بررسی تغییرات مورفولوژیکی، رنگآمیزی اکریدین اورنج / اتیدیوم بروماید استفاده شد و فعالیت پروآپوپتوزی با سنجش Annexin-V-FITC / PI و تغییرات چرخه سلولی بررسی شد. در مطالعه مذکور گیاه شوید بقای سلولهای سرطانی را به صورت وابسته به غلظت کاهش داد و همچنین تغییرات مورفولوژیکی مانند جوانهزنی غشای سلولی و تراکم هستهای نمایان شد که نشان از وقوع آپوپتوز داشت. سپس سنجش Annexin-V-FITC / PI و تغییرات چرخه سلولی رویداد آپوپتوز را اثبات کرد [13].
در مطالعهای که روی موشهایی با کلسترول بالا صورت گرفت مشخص شد مصرف عصاره شوید در دُز 500 میلیگرم در روز به مدت 30 روز سطح لیپید سرمی و پراکسیداسیون لیپیدی در کبد را کاهش میدهد [30]. با توجه به نتایج این تحقیق و انجام مطالعات بیشتر روی سایر سلو لها و انجام آزمایشات بیشتر در محیط in vivo میتوان از دُزهای مناسب این ترکیب برای اهداف زیست پزشکی بهره جست.
نتیجهگیری
در پژوهشی که انجام شد، نانوامولسیون سنتزشده توسط اسانس گیاه شوید دارای فعالیت آنتیاکسیدانی قوی بود. این خاصیت نشانگر پتانسیل تبدیلشدن این نانوامولسیون به یک استراتژی درمانی برای بیماریهای ناشی از استرس اکسیداتیو و سرطان در آینده است. پیشنهاد میشود به منظور بررسی سمیت مؤثر روی سایر ردههای سلولهای سرطانی نیز مطالعه صورت گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
تمامی آزمایشهای این تحقیق با رعایت موازین اخلاقی و طبق تأیید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی با شناسه مصوبه IR.IAU.MSHD.REC.1398.027 انجام شد.
حامی مالی
این تحقیق هیچ کمک مالی خاصی از سازمانهای تأمین مالی در بخشهای دولتی، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
مفهومسازی: مسعود همایونی تبریزی؛ روششناسی: مسعود همایونی تبریزی، توران اردلان؛ اعتبارسنجی: مسعود همایونی تبریزی، توران اردلان تحلیل، تحقیق و بررسی: هاله توکل افشار؛ منابع: هاله توکل افشار؛ نگارش پیشنویس: هاله توکل افشار؛ ویراستاری و نهاییسازی نوشته: مسعود همایونی تبریزی، توران اردلان؛ بصریسازی، نظارت، مدیریت پروژه، تأمین مالی: مسعود همایونی تبریزی
تعارض منافع
طبق نظر نویسندگان این مقاله هیچگونه تعارض منافعی ندارد.
References
- Misra R, Acharya S, Sahoo SK. Cancer nanotechnology: Application of nanotechnology in cancer therapy. Drug Discov Today. 2010; 15(19-20):842-50. [DOI:10.1016/j.drudis.2010.08.006] [PMID]
- Wang X, Yang L, Chen ZG, Shin DM. Application of nanotechnology in cancer therapy and imaging. CA Cancer J Clin. 2008; 58: 97-110. [DOI:10.3322/CA.2007.0003] [PMID]
- Alexis F, Rhee JW, Richie JP, Radovic-Moreno AF, Langer R, Farokhzad OC. New frontiers in nanotechnology for cancer treatment. Urologic Oncology. 2008; 26(1):74-85. [DOI:10.1016/j.urolonc.2007.03.017] [PMID]
- Sahu P, Das D, Mishra VK, Kashaw V, Kashaw SK. Nanoemulsion: A novel eon in cancer chemotherapy. Mini- Rev Med Chem. 2017; 17(18):1778-92. [DOI:10.2174/1389557516666160219122755] [PMID]
- Javadzadeh Y, Bahari L. Therapeutic nanostructures for dermal and transdermal drug delivery. In: Mihai Grumezescu A, editor. Nano-and Microscale Drug Delivery Systems. Amsterdam: Elsevier; 2017. [DOI:10.1016/B978-0-323-52727-9.00008-X]
- Priya LB, Baskaran R, Padma VV. Phytonanoconjugates in oral medicine. In: Andronescu E, Mihai Grumezescu A, editors. Nanostructures for oral Medicine. Amsterdam: Elsevier; 2017. [DOI:10.1016/B978-0-323-47720-8.00022-5]
- Teo A, Goh KK, Lee SJ. Nanoparticles and nanoemulsions. In: Kumar Anal A, Ahmad I, Noomhorm A, editors. Functional foods and dietary supplements: Processing effects and health benefits. Hoboken: John Wiley & Sons, Ltd. Publication; 2014. [DOI:10.1002/9781118227800.ch15] [PMID] [PMCID]
- Praveen Kumar G, Divya A. Nanoemulsion based targeting in cancer therapeutics. Med Chem. 2015; 5(5):272-84. [DOI:10.4172/2161-0444.1000275]
- Ostróżka-Cieślik A, Sarecka-Hujar B. The use of nanotechnology in modern pharmacotherapy. In: Mihai Grumezescu A, editor. Multifunctional systems for combined delivery, biosensing and diagnostics. Amsterdam: Elsevier; 2017. [DOI:10.1016/B978-0-323-52725-5.00007-1]
- Kundu B, Ghosh D, Sinha MK, Sen PS, Balla VK, Das N, et al. Doxorubicin-intercalated nano-hydroxyapatite drug-delivery system for liver cancer: An animal model. Ceram Int. 2013; 39(8):9557-66. [DOI:10.1016/j.ceramint.2013.05.074]
- Jeon MJ, Gordon AC, Larson AC, Chung JW, Kim YI, Kim D-H. Transcatheter intra-arterial infusion of doxorubicin loaded porous magnetic nano-clusters with iodinated oil for the treatment of liver cancer. Biomat. 2016; 88:25-33. [DOI:10.1016/j.biomaterials.2016.02.021] [PMID] [PMCID]
- Yu H, Huang Q. Investigation of the cytotoxicity of food-grade nanoemulsions in Caco-2 cell monolayers and HepG2 cells. Food Chem. 2013; 141(1):29-33. [DOI:10.1016/j.foodchem.2013.03.009] [PMID]
- Mohammed FA, Elkady AI, Syed FQ, Mirza MB, Hakeem KR, Alkarim S. Anethum graveolens (dill)-A medicinal herb induces apoptosis and cell cycle arrest in HepG2 cell line. J Ethnopharmacol. 2018; 219:15-22. [DOI:10.1016/j.jep.2018.03.008] [PMID]
- Mohammed FA, Razvi SS, Abdul WM, Mohammed K, Hakeem KR, Banaganapalli B, et al. Protective role of medicinal herb anethum graveolens (Dill) against various human diseases and metabolic disorders. In: Ozturk M, Hakeem KH, editors. Plant and Human Health. Berlin:Springer; 2019. [DOI:10.1007/978-3-030-04408-4_8]
- Oshaghi EA, Tavilani H, Khodadadi I, Goodarzi MT. Dill tablet: A potential antioxidant and anti-diabetic medicine. Asian Pac J Trop Biomed. 2015; 5(9):720-7. [DOI:10.1016/j.apjtb.2015.06.012]
- Safarzadeh E, Shotorbani SS, Baradaran B. Herbal medicine as inducers of apoptosis in cancer treatment. Adv Pharm Bull. 2014; (Suppl. 1) 4(5):421-7. [DOI:10.5681/apb.2014.062] [PMID] [PMCID]
- Van Meerloo J, Kaspers GJ, Cloos J. Cell sensitivity assays: The MTT assay. Methods Mol Biol. 2011; 731:237-45. [DOI:10.1007/978-1-61779-080-5_20] [PMID]
- Shalaby EA, Shanab SM. Comparison of DPPH and ABTS assays for determining antioxidant potential of water and methanol extracts of Spirulina platensis. Indian J Geo-Marine Sci. 2013; 42(5):556-64.
- Garcia EJ, Oldoni TL, Alencar SM, Reis A, Loguercio AD, Grande RH. Antioxidant activity by DPPH assay of potential solutions to be applied on bleached teeth. Braz Dent J. 2012; 23(1):22-7. [DOI:10.1590/S0103-64402012000100004] [PMID]
- Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Bio Med. 1999; 26(9-10):1231-7. [DOI:10.1016/S0891-5849(98)00315-3]
- Severino P, Fangueiro JF, Ferreira SV, Basso R, Chaud MV, Santana MH, et al. Nanoemulsions and nanoparticles for non-melanoma skin cancer: Effects of lipid materials. Clin Transl Oncol. 2013; 15(6):417-24. [DOI:10.1007/s12094-012-0982-0] [PMID]
- Yazdanparast R, Bahramikia S. Evaluation of the effect of anethum graveolens L. crude extracts on serum lipids and lipoproteins profiles in hypercholesterolaemic rats. Darg J Pharm Sci. 2008; 16(2):88-94.
- Zheng GQ, Kenney PM, Lam LK. Anethofuran, carvone, and limonene: Potential cancer chemoprotective agents from dill weed oil and caraway oil. Planta Medica. 1992; 58(4):338-41. [DOI:10.1055/s-2006-961480] [PMID]
- Moghaddasi F, Housaindokht MR, Darroudi M, Bozorgmehr MR, Sadeghi A. Synthesis of nano curcumin using black pepper oil by O/W nanoemulsion technique and investigation of their biological activities. LWT. 2018; 92:92-100. [DOI:10.1016/j.lwt.2018.02.023]
- Lou Z, Chen J, Yu F, Wang H, Kou X, Ma C, et al. The antioxidant, antibacterial, antibiofilm activity of essential oil from Citrus medica L. var. sarcodactylis and its nanoemulsion. LWT. 2017; 80:371-7. [DOI:10.1016/j.lwt.2017.02.037]
- Orhan IE, Senol FS, Ozturk N, Celik SA, Pulur A, Kan Y. Phytochemical contents and enzyme inhibitory and antioxidant properties of Anethum graveolens L.(dill) samples cultivated under organic and conventional agricultural conditions. Food Chem Toxicol. 2013; 59:96-103.[DOI:10.1016/j.fct.2013.05.053] [PMID]
- Stanojevic L, Stanković MZ, Cvetković D, Danilović B, Stanojević J. Dill (anethum graveolens L.) seeds essential oil as a potential natural antioxidant and antimicrobial agent. Biologica Nyssana. 2016; 7(1):31-9.
- Periasamy VS, Athinarayanan J, Alshatwi AA. Anticancer activity of an ultrasonic nanoemulsion formulation of Nigella sativa L. essential oil on human breast cancer cells. Ultrason Sonochem. 2016; 31:449-55.[DOI:10.1016/j.ultsonch.2016.01.035] [PMID]
- Jerobin J, Makwana P, Kumar RS, Sundaramoorthy R, Mukherjee A, Chandrasekaran N. Antibacterial activity of neem nanoemulsion and its toxicity assessment on human lymphocytes in vitro. Int J Nanomedicine. 2015; 10(1):77-86. [DOI:10.2147/IJN.S79983] [PMID] [PMCID]
- Meriem T. Chemical Composition And Anti-inflammatory Activity Of Myrtus Communis L. Essential Oil, Phytothérapie. Algerian J Arid Environ. 2016; 6(2):1-10.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |