دوره 22، شماره 5 - ( آذر و دی 1398 )
جلد 22 شماره 5 صفحات 77-68 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Fallahzadeh R, Esfahani K, Akhavan Sepahi A, Kamali N, Bambai B. Increasing the catalytic power of the flavin reductase DszD enzyme using site-directed mutagenesis method in Rhodococcus erythropolis. J Arak Uni Med Sci 2019; 22 (5) :68-77
URL: http://jams.arakmu.ac.ir/article-1-6094-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6094-fa.html
فلاح زاده رامین، اصفهانی کسری، اخوان سپهی عباس، کمالی نسرین، بمبئی بیژن. افزایش قدرت کاتالیتیکی آنزیم فلاوین ردوکتاز DszD: آنزیم کلیدی در فرآیند گوگردزدایی باکتریایی. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (5) :68-77
رامین فلاح زاده1 

 ، کسری اصفهانی2
، کسری اصفهانی2 

 ، عباس اخوان سپهی1
، عباس اخوان سپهی1 

 ، نسرین کمالی2
، نسرین کمالی2 

 ، بیژن بمبئی
، بیژن بمبئی 

 3
3


 ، کسری اصفهانی2
، کسری اصفهانی2 

 ، عباس اخوان سپهی1
، عباس اخوان سپهی1 

 ، نسرین کمالی2
، نسرین کمالی2 

 ، بیژن بمبئی
، بیژن بمبئی 

 3
3
1- گروه میکروبیولوژی، دانشکده علوم زیستی، واحد تهران شمال، دانشگاه آزاد اسلامی، تهران، ایران.
2- گروه ژنتیک پزشکی، پژوهشکده زیستفناوری پزشکی، پژوهشگاه ملی مهندسی ژنتیک و زیستفناوری، تهران، ایران.
3- گروه ژنتیک پزشکی، پژوهشکده زیستفناوری پزشکی، پژوهشگاه ملی مهندسی ژنتیک و زیستفناوری، تهران، ایران. ، bambai@nigeb.ac.ir
2- گروه ژنتیک پزشکی، پژوهشکده زیستفناوری پزشکی، پژوهشگاه ملی مهندسی ژنتیک و زیستفناوری، تهران، ایران.
3- گروه ژنتیک پزشکی، پژوهشکده زیستفناوری پزشکی، پژوهشگاه ملی مهندسی ژنتیک و زیستفناوری، تهران، ایران. ، bambai@nigeb.ac.ir
متن کامل [PDF 2730 kb]
(1105 دریافت)
| چکیده (HTML) (2867 مشاهده)
تکثیر ژن dszD نوع وحشی و جهشیافته و همسانهسازی آن
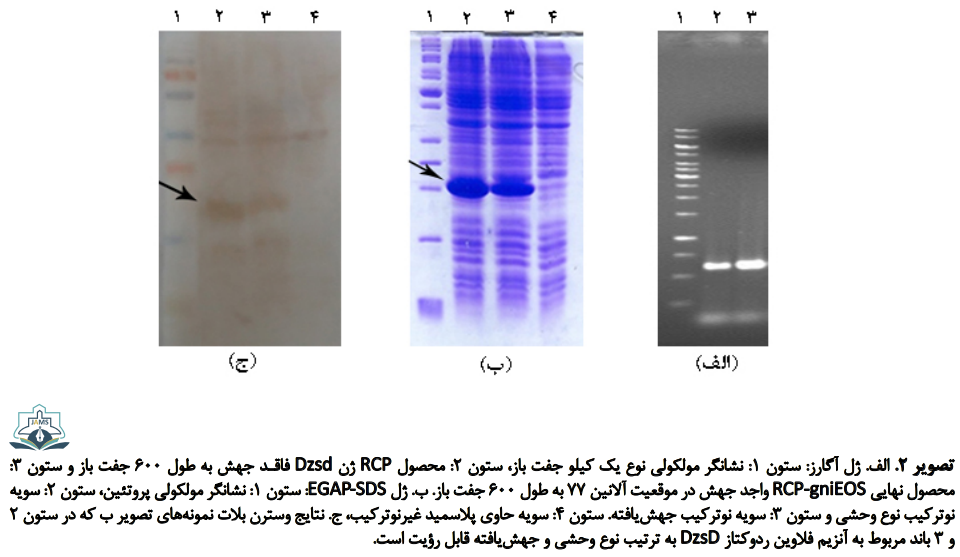
تکثیر ژن dszD نوع وحشی با استفاده از پرایمرهای اختصاصی DszD-F و DszD-R انجام شد (تصویر شماره 2. (الف) ستون 1). همچنین ژن dszD جهشیافته در موقعیت 77 با استفاده از پرایمر جهشزا حاصل شد. برای این منظور قطعات آمپلیکون حاصل از PCRهای اول و دوم، تخلیص و به عنوان الگو برای PCRسوم قرار گرفتند (تصویر شماره 2. (الف) ستون 2). پس از هضم آنزیمی وکتور pET-23a (+) و قطعات تکثیرشده نهایی، هرکدام به صورت جداگانه به منظور تولید پلاسمید نوترکیب طی واکنش اتصال به هم متصل شدند. نتایج توالییابی صحت همسانهسازی را تأیید کرد.
پلاسمیدهای نوترکیب حاوی ژن نوع وحشی و جهشیافته هرکدام به صورت جداگانه به سویه بیانیE.coli BL21 (DE3) منتقل شدند. نتایج آزمایشگاهی بیان مناسب ژنهای همسانهسازیشده مدنظر را نشان داد که دارای باند مشخص بر روی ژل پلیآکریلامید با وزن مولکولی 24 کیلو دالتون هستند (تصویر شماره 2. "ب"). آنالیز وسترن بلات، حضور سطح معنیدار بیان آنزیم فلاوین ردوکتاز DszD نوترکیب وحشی و جهشیافته را تأیید کرد (تصویر شماره 2. "ج").
بررسی قدرت کاتالیتیکی آنزیم فلاوین ردوکتاز DszD نوع وحشی و جهشیافته
نتایج مقایسه میانگین قدرت کاتالیتیکی آنزیم فلاوین ردوکتاز DszD نوع وحشی و جهشیافته نشان داد آنزیم جهشیافته دارای قدرت کاتایتیکی به میزان 6±392 یونیت بر میلیگرم است که نسبت به آنزیم نوع وحشی (4±160 یونیت بر میلیگرم) به میزان 5/2 برابر افزایش فعالیت دارد.
بحث
امروزه به دلیل تصویب قوانین سختگیرانه زیستمحیطی، استفاده از روشهای مهندسی ژنتیک جهت حذف اختصاصی گوگرد از سوختهای فسیلی مورد توجه بسیاری از محققین قرار گرفته است. تاکنون در این راستـا پیشرفتهای قابل توجـهی حاصل شده است، بهویژه آنکه در رابطه با بررسی و ارزیابی مکانیسمهای گوگردزدایی باکتریایی دستاوردهای مهمی نیز کسب شده است [24]. اگرچه در اغلب تحقیقاتی که تاکنون انجام شده است، کوششها مبتنی بر استفاده از روشهای میکروبیولوژی و بیوشیمیایی بوده است، آنچه که بیش از همه جلب توجه کرده است، مسیر متـابولیکی و بسیار اختـصاصی 4S در میکروارگانیسم هـوازی رودوکوکوس اریتروپولیس سویه IGTS8 است که بدون آسیب به شبـکه کربنی، قادر به حذف گوگرد از ترکیبات نفتی است [25].
در فرایند 4S، آنزیم فلاوین ردوکتاز DszD به سهم خود یک آنزیم محدودکننده سرعت فرایند گوگردزدایی است و به عنوان آنزیم کلیدی نقش اصلی را به عهده داشته و میزان قدرت آن بر سرعت انتقال اکسیداتیو اثر مستقیم دارد. با توجه به اینکه در صنعت، هدف این است که با صرف انرژی کمتر و زمان کوتاهتر بتوان به راندمان مناسب دست یافت، بنابراین میتوان به آنزیم فلاوین ردوکتاز DszD به عنوان یکی از عوامل کاتالیتیکی مؤثر در زنجیره حذف گوگرد روی آورد. اما از آنجا که قدرت این کاتالیزور زیستی در شرایط عادی پایین است [26]، از طریق ایجاد جهش هدفمند و منطقی در کیفیت آمینو اسیدهای متصل به سوبسـترا و مؤثر در کاتالــیز که در جایگاه فـعال آنزیمی قـرار گرفـته باشند، مـیتوان به مولکول زیسـتی با ویژگیهای مـطلوب و قابلیتهای مــورد انتظار دسـت یافـت [27].
چن و همکاران مولکول جهشیافته جدیدی از آنزیم ایزوپنتیل دی فسفات ایزومراز به وسیله روش ترکیبی جهشزایی هدفمند و جهشزایی تصادفی ایجاد کردند. در این آنزیم، آمینو اسیدهای تیروزین 195، تریپتوفان 256 و لیزین 141 به ترتیب با آمینو اسیدهای فنیل آلانین، سیستئین و هیستیدین جایگزین شدند. نتایج این مطالعه افزایش فعالیت کاتالیتیک آنزیم جهشیافته نسبت آنزیم نوع وحشی به میزان 1/2 برابر را نشان داد. علاوه بر آن افزایش پایداری در pH، ارتقای پایداری دمایی و نیمه عمر طولانیتر به عنوان اثرات دیگر جهش ایجادی گزارش شد [28].
دوان و همکاران نیز مولکولهای موتانت متعددی از آنزیم پولولاناز ایجاد کردند که فعالیت کاتالیتیکی، پایداری دمایی و قدرت اتصال به سوبسترا در آنها نسبت به آنزیم نوع وحشی بهبود یافته بود [29]. در مطالعه قبلی ما، ترئونین موجود در موقعیت 62 آنزیم با آمینو اسید آسپارژین جایگزین شد و به دلیل نزدیکشدن آمینو اسید آسپارژین به حلقه ایزوالکسازین در سوبسترای FMN نسبت به ترئونین، افزایش در سرعت انتقال الکترون و در نتیجه افزایش فعالیت آنزیم فلاوین ردوکتاز DszD گزارش شد [18].
در این مطالعه، فعالیت آنزیمی بعد از ایجاد جهش هدفمند در آمینو اسید آسپارژین موقعیت 77 به عنوان یکی از باقیماندههای کلیدی دیگر در جایگاه فعال آنزیم بررسی شد. نتایج آزمایشگاهی نشان داد که آنزیم جهشیافته در مقایسه با آنزیم نوع وحشی از قدرت کاتالیتیکی بالاتری برخوردار است. در آنزیم جهشیافته مدنظر، زنجیره جانبی قطبی موجود در آسپارژین که دارای گروه آمین و کربنیل است، جایگزین گروه غیرقطبی حلقه بنزنی شده است و توالی آمینو اسیدی ازPhe76-Asn77-Ile78در آنزیم تیپ وحشی به Phe76-Phe77-Ile78 در آنزیم جهشیافته تغییر یافته است.
نتایج سنجش فعالیت بیولوژیک نشان داد فعالیت آنزیم جهشیافته در مقایسه با فعالیت آنزیم نوع وحشی به میزان 5/2 برابر افزایش یافته است. با توجه به اینکه آمینو اسید فنیل آلانین، غیرقطبی و فاقد هرگونه بار اسیدی و بازی است، بنابراین نمیتوان مستقیماً برای آن در اتصال به سوبسترا نقشی قائل شد. از طرفی قرارگرفتن دو آمینو اسید حجیم فنیل آلانین در مجاورت یکدیگر، منجر به تاخوردگی آنها به سمت داخل مولکول شده و میتواند احتمال در معرض قرارگرفتن آمینو اسیدهای قطبی مجاور آنها را افزایش دهد و با ایجاد فضای بازتر در جایگاه فعال آنزیم به جایگیری مناسب و سریعترFMN قطبی کمک کند. از آنجا که منابع متعدد، موقعیت ترئونین 62 را با اهمیت و دارای نقش کلیدی در انتقال مستقیم هیدرید جهت انجام فعالیت اکسیدوردوکتازی آنزیم معرفی کردهاند [18 ،17]، این فرضیه ایجاد میشود که با در معرض قرارگرفتن بیشتر آمینو اسیدهای قطبی، امکان اتصال مناسبتر سوبسترا در جایگاه فعال فراهم شده و درنتیجه فعالیت اکسیدوردوکتازی آنزیم افزایش مییابد.
نتیجهگیری
این مطالعه نشان میدهد که آنزیم مدنظر، پتانسیل مناسبی جهت افزایش قدرت کاتالیتیکی در مسیر 4S دارد. بنابراین، جهش هدفمند در آنزیم فلاوین ردوکتاز DszD و فعالیت آن در سلولهای میزبان نوترکیب میتواند باعث افزایش راندمان فرایند گوگردزدایی با استفاده از سیستم باکتریایی شود. پیشنهاد میشود که مولکول جهشیافته واجد جهش در چندین موقعیت کلیدی، تولید شود و قدرت کاتالیتیکی آن با جهشیافتههای گزارششده، مقایسه شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با کد IR.NIGEB.EC.1398.6.24 A به تأیید کمیته اخلاق پژوهشی پژوهشگاه ملی مهندسی ژنتیک و زیستفناوری رسیده است. این مطالعه فاقد نمونه انسانی و هرگونه شرکتکننده است؛ بنابراین نیازی به رضایتنامه نبود. مطالعه صرفاً بر روی آنزیم صنعتی انجام شده است.
حامی مالی
این مطالعه بدون هرگونه حمایت مالی صورت گرفته است.
مشارکت نویسندگان
مفهومسازی، تحقیق و بررسی، ویراستاری و نهاییسازی نوشته: کلیه نویسندگان.
تعارض منافع
نویسندگان تصریح میکنند هیچگونه تضاد منافعی در این پژوهش وجود ندارد.
متن کامل: (1847 مشاهده)
مقدمه
استفاده از سوختهای فسیلی و ترکیبات نفتی، سبب افزایش اکسیدهای گوگردی در محیط زیست و بروز مشکلات زیستمحیطی متعددی از قبیل باران اسیدی، آلودگی هوا و بسیاری از بیماریهای قلبی، تنفسی، پوستی و گوارشی برای انسان میشود [2 ،1]. نفت و مشتقات آن دارای طیف وسیعی از انواع ترکیبات گوگردی حلقوی و هتروسیکلهای آروماتیک بر پایه تیوفن هستند. برای کاهش سطح دی اکسید گوگرد آزادشده به اتمسفر، کاهش میزان گوگرد در سوختهای فسیلی امری ضروری است. روشهای مختلفی برای کاهش محتوای گوگردی ترکیبات گوگردی حلقوی و هتروسیکلهای آروماتیک در صنعت تصفیه استفاده میشوند که رایجترین آنها استفاده از گوگردزدایی به روش شیمیایی است[4 ،3].
این فرایند یک واکنش کاتالیتیکی است که در آن گوگرد آلی تحت فشار و دمای بالا با استفاده از گاز هیدروژن در حضور کاتالیزورهای فلزی، احیا شده و به گاز سولفید هیدروژن تبدیل میشود. حذف گوگرد به روش شیمیایی از راندمان مناسبی برخوردار نیست و نیاز به سیستمهای حرارتی پرقدرت، فشار بالا، صرف انرژی بالا و کاتالیستهای فلزی پرهزینه دارد [6 ،5]. از سوی دیگر بیش از 70 درصد ترکیبات هتروسیکلیک مانند دیبنزوتیوفن و مشتقات آن به این روش مقاوم هستند و گوگرد آن از واکنش حذف نمیشود [7].
با توجه به معایب اشارهشده، اخیراً روشهای گوگردزدایی متعددی از جمله روش اکسیداتیو، جاذب و میکروبی توسعه یافته است [8-10]. روش گوگردزدایی میکروبی، قادر است گوگرد موجود در مشتقات پلیسیکلی نفت را بدون شکستن اسکلت کربن و کاهش ارزش انرژی سوخت حذف کند [12 ،11]. در راستای توسعه این روش میکروارگانیسمهای متعددی شناسایی شدهاند که قادر به حذف اختصاصی گوگرد هستند که از آن جمله میتوان به رودوکوکوس اریتروپولیس، آگرو باکتریوم، بعضی از کلبسیلاها، نوکاردیاها و پاینی باسیلوسها اشاره کرد [14 ،13].
فرایند گوگردزدایی در این میکروارگانیسمها از طریق شکستهشدن پیوند بین گوگرد و کربن در مولکول هدف طی مسیری موسوم به مسیر 4S انجام میشود. این مسیر اولین بار در باکتری گرم منفی رودوکوکوس اریتروپولیس با شناسه دسترسی ATCC53968 معرفی گردید. رودوکوکوس اریتروپولیس توانایی حذف اختصاصی گوگرد بدون آسیب به اسکلت کربنی و بدون کاهش در ارزش انرژی سوخت فسیلی را دارد [15]. این باکتری از گوگرد موجود در دیبنزوتیوفن و مشتقات آن به عنوان تنها منبع تغدیه، استفاده مینماید. این باکتری دارای آنزیمهای DszA، DszB، DszC و DszD است که آنزیمهای DszA و DszC کد کننده مونواکسیژناز، آنزیم DszB دسولفیناز و آنزیم DszD، یک فلاوین ردوکتاز وابسته به سوبسترای FMN است کهFMNH2لازم برای فعالیت آنزیمهای DszC و DszA را فراهم میکند [17 ،16].
واکنش فعال گوگردزدایی در حضور فلاوین ردوکتاز DszD (2944380 ig) نجام میشود. در واقع آنزیم اخیر با 192 آمینو اسید و وزن مولکولی حدود 22 کیلو دالتون آنزیم کلیدی این فرایند محسوب میشود. به طور طبیعی، این آنزیم قدرت کاتالیتیکی پایینی دارد و از این رو عامل اصلی محدودکننده سرعت فرایند گوگردزدایی در صنعت پالایش شناخته شده است. یکی از عوامل مهم برای افزایش سرعت این فرآیند، افزایش قدرت کاتالیتیکی آنزیم DszD است. در مطالعه قبلی ما، افزایش فعالیت آنزیمی از طریق جایگزین نمودن آمینو اسیدهای آلانین و آسپارژین به جای باقیمانده ترئونین در موقعیت 62 گزارش شده بود [18].
در این مطالعه ما علاقهمند بودیم با جهشزایی در باقیمانده کلیدی دیگر در اتصال با سوبسترای FMN قدرت کاتالیتیکی آنزیم را بررسی کنیم. به همین دلیل ابتدا، پیشگویی ساختار سهبعدی با هدف شناسایی باقیماندههای کلیدی انجام شد. از بین چهار باقیمانده کلیدی شناسایی شده، باقیمانده آسپارژین در موقعیت 77 با استفاده از روش جهشزایی هدفمند با فنیل آلانین جایگزین شد. درنهایت قدرت کاتالیتیکی آنزیمهای وحشی و جهشیافته مورد مقایسه قرار گرفت.
مواد و روشها
شناسایی باقیماندههای کلیدی آنزیم فلاوین ردوکتاز DszD جهت اتصال به سوبسترا
توالی آمینو اسیدهای آنزیم DszD در پایگاه NCBI با عدد دسترسی AAC38226.1 موجود است. به منظور شناسایی مولکول همولوگ با شباهت قابل قبول، توالی آنزیم هدف در پایگاه داده پروتئین جستوجو شد [19]. در بین همولوگهای شناساییشده، همولوگهای متصل به سوبسترای FMN انتخاب و همترازی آنها با یکدیگر از طریق ابزار BLAST انجام شد.
مواد شیمیایی، سویه باکتریایی، پلاسمیدها و پرایمرها
DNA ژنومی از سویه باکتریایی رودوکوکوس اریتروپولیس IGTS8 تهیه شد. وکتور کلونینگ pBluescript II KS (+) از فرمنتاز و وکتور بیانی pET-23a (+) از Novagen بودند. DNA پلیمراز، آنزیمهای برشی BamHI و EcoRI، T4 Ligase، کیت استخراج ژل آگارز (Cat. No. 11696505001) و کیت تخلیص محصول RCP Cat. No. 11732668001)) از شرکت Roche آلمان؛ کیت استخراج AND Cat. No. K1014-100)) و کیت تخلیص پلاسمید (Cat. No. K2014-100) از شرکت Qiagen و نشانگرهای پروتئینی و آنتیبادی T7 tag از شرکت فرمنتاز لیتوانی خریداری شد.
تکثیر و همسانهسازی ژن dszD نوع وحشی و جهشیافته
ژن dszD نوع وحشی با استفاده از PCR از طریق پرایمرهای پیشرو و پسرو به ترتیب ATGGATCCATGTCTGACAAGCCGAATGC و GTAGAATTCCTACTATTGACCTAACGGAGTCGG تکثیر شد که به ترتیب دارای جایگاه برش برای آنزیمهای محدودکننده BamHI و EcoRI بودند (نوکلئوتیدهایی که زیر آن خط کشیده شده است، جایگاه برش آنزیمهای محدودکننده را نشان میدهد). ژن جهشیافته dszD با استفاده از روش SOEing-PCR، ایجاد شد [20]. پرایمرهای پیشرو و پسرو برای ایجاد جهش در موقعیت 77 به ترتیب 5/-CGTCTCGTTCTTCATCGCGGAG-3/ و 5/-CTCCGCGATGAAGAACGAGACG-3/ بودند. ژن نوع وحشی و جهشیافته حاصل به طول 600 جفت باز به صورت جداگانه درون وکتور بیانی pET-23a (+) همسانهسازی شدند و سپس به سلولهای E. coli BL21 (DE3) منتقل شدند. صحت همسانهسازی با استفاده از دو آنزیم محدودکننده مذکور و همچنین توالییابی انجام شد. روشهای مولکولی بر اساس پروتکل استاندارد Russelو Sambrook انجام شدند [21].
القای بیان، الکتروفورز ژل آکریلامید و وسترن بلات
وکتورهای بیانی pET-23a حاوی ژنهای وحشی و جهشیافته، هرکدام به صورت جداگانه به میزبان بیانی (E. coli BL21 (DE3 منتقل شدند. میزبانهای نوترکیب در محیط کشت LB در دمای 37 درجه سانتیگراد کشت داده شد تا به چگالی نوری 7/0 رسیدند. به منظور بررسی بیان میزبانهای فوق از محیط کشت حاوی IPTG با غلظت نهایی 1/0 میلیمولار استفاده شد. برای لیز سلولی از بافر نمونه حاوی 80 میلیمولار (6/8 pH)Tris-Hclسدیم دو دسیل سولفات 2 درصد، گلیسرول 10 درصد و معرف برموفنول آبی 2/0 درصد استفاده شد.
جهت مشاهده الگوی پروتئینی، نمونهها بر روی ژلپلیآکریلامید (5/12 درصد) الکتروفورز و توسط محلول کوماسی بلو رنگآمیزی شدند. به منظور اجرای وسترن بلات، پروتئینهای تفکیکشده بر روی ژل در مجاورت با غشای PVDF با شدت جریان 200 میلیآمپر قرار گرفتند. بعد از اتمام انتقال پروتئینها، غشا در محلول BSA غوطهور شد. سپس غشا به داخل محلول آنتیبادی T7 tag و بافر TBS-T به نسبت 1 به 1000 قرار گرفت. پس از شستوشو با بافر فوق، غشا به مدت یک ساعت در محلول حاوی آنتیبادی ضد T7 tag(HRP) و بافر TBS-T به نسبت 1 به 2500 قرار داده شد. درنهایت جهت آشکارسازی پروتئینهای منتقلشده بر روی غشا از محلول سوبسترای آنزیم پراکسیداز شامل دیآمینوبنزیدین 5/0 میلیگرم در میلیلیتر و پراکسید هیدروژن 1/0 درصد در TBS استفاده شد [22].
سنجش قدرت کاتالیتیکی آنزیم فلاوین ردوکتاز DszD
جهت بررسی قدرت کاتالیتیکی آنزیم DszD، ابتدا پروتئینهای بیانشده در محلول حاوی 50 میلیمولار Tris/HCl (pH 7/5)، 140 میکرومولار NADH و 20 میکرومولار FMN حل شدند. سپس جذب نوری آنها در طول موج 340 نانومتر طی اکسیداسیون NADH به NAD در واحد زمان سنجش شد [18]. غلظت پروتئین با استفاده از روش برادفورد با BSA به عنوان استاندارد تعیین شد [23].
یافتهها
جستوجوی توالی آمینو اسید آنزیم فلاوین ردوکتاز DszD در پایگاه داده پروتئینی، مولکولهای همولوگ با ساختمان کریستالوگرافی مشخص را معرفی کرد. مولکولهای همولوگ با بالاترین شباهت ساختاری به آنزیم هدف و متصل به سوبسترای FMN، به عنوان الگوی مناسب جهت شناسایی موقعیتهای کلیدی، انتخاب شدند. نتایج همترازی توالی آمینو اسیدهای آنزیم DszD با مولکولهای همولوگ انتخاب شده، نشان داد جایگاه فعال آنزیم هدف دارای چهار موقعیت کلیدی جهت اتصال به سوبسترای FMN است که عبارتاند از: ترئونین 62، سرین 63، آسپارژین 77 و آلانین 79 (تصویر شماره 1).
استفاده از سوختهای فسیلی و ترکیبات نفتی، سبب افزایش اکسیدهای گوگردی در محیط زیست و بروز مشکلات زیستمحیطی متعددی از قبیل باران اسیدی، آلودگی هوا و بسیاری از بیماریهای قلبی، تنفسی، پوستی و گوارشی برای انسان میشود [2 ،1]. نفت و مشتقات آن دارای طیف وسیعی از انواع ترکیبات گوگردی حلقوی و هتروسیکلهای آروماتیک بر پایه تیوفن هستند. برای کاهش سطح دی اکسید گوگرد آزادشده به اتمسفر، کاهش میزان گوگرد در سوختهای فسیلی امری ضروری است. روشهای مختلفی برای کاهش محتوای گوگردی ترکیبات گوگردی حلقوی و هتروسیکلهای آروماتیک در صنعت تصفیه استفاده میشوند که رایجترین آنها استفاده از گوگردزدایی به روش شیمیایی است[4 ،3].
این فرایند یک واکنش کاتالیتیکی است که در آن گوگرد آلی تحت فشار و دمای بالا با استفاده از گاز هیدروژن در حضور کاتالیزورهای فلزی، احیا شده و به گاز سولفید هیدروژن تبدیل میشود. حذف گوگرد به روش شیمیایی از راندمان مناسبی برخوردار نیست و نیاز به سیستمهای حرارتی پرقدرت، فشار بالا، صرف انرژی بالا و کاتالیستهای فلزی پرهزینه دارد [6 ،5]. از سوی دیگر بیش از 70 درصد ترکیبات هتروسیکلیک مانند دیبنزوتیوفن و مشتقات آن به این روش مقاوم هستند و گوگرد آن از واکنش حذف نمیشود [7].
با توجه به معایب اشارهشده، اخیراً روشهای گوگردزدایی متعددی از جمله روش اکسیداتیو، جاذب و میکروبی توسعه یافته است [8-10]. روش گوگردزدایی میکروبی، قادر است گوگرد موجود در مشتقات پلیسیکلی نفت را بدون شکستن اسکلت کربن و کاهش ارزش انرژی سوخت حذف کند [12 ،11]. در راستای توسعه این روش میکروارگانیسمهای متعددی شناسایی شدهاند که قادر به حذف اختصاصی گوگرد هستند که از آن جمله میتوان به رودوکوکوس اریتروپولیس، آگرو باکتریوم، بعضی از کلبسیلاها، نوکاردیاها و پاینی باسیلوسها اشاره کرد [14 ،13].
فرایند گوگردزدایی در این میکروارگانیسمها از طریق شکستهشدن پیوند بین گوگرد و کربن در مولکول هدف طی مسیری موسوم به مسیر 4S انجام میشود. این مسیر اولین بار در باکتری گرم منفی رودوکوکوس اریتروپولیس با شناسه دسترسی ATCC53968 معرفی گردید. رودوکوکوس اریتروپولیس توانایی حذف اختصاصی گوگرد بدون آسیب به اسکلت کربنی و بدون کاهش در ارزش انرژی سوخت فسیلی را دارد [15]. این باکتری از گوگرد موجود در دیبنزوتیوفن و مشتقات آن به عنوان تنها منبع تغدیه، استفاده مینماید. این باکتری دارای آنزیمهای DszA، DszB، DszC و DszD است که آنزیمهای DszA و DszC کد کننده مونواکسیژناز، آنزیم DszB دسولفیناز و آنزیم DszD، یک فلاوین ردوکتاز وابسته به سوبسترای FMN است کهFMNH2لازم برای فعالیت آنزیمهای DszC و DszA را فراهم میکند [17 ،16].
واکنش فعال گوگردزدایی در حضور فلاوین ردوکتاز DszD (2944380 ig) نجام میشود. در واقع آنزیم اخیر با 192 آمینو اسید و وزن مولکولی حدود 22 کیلو دالتون آنزیم کلیدی این فرایند محسوب میشود. به طور طبیعی، این آنزیم قدرت کاتالیتیکی پایینی دارد و از این رو عامل اصلی محدودکننده سرعت فرایند گوگردزدایی در صنعت پالایش شناخته شده است. یکی از عوامل مهم برای افزایش سرعت این فرآیند، افزایش قدرت کاتالیتیکی آنزیم DszD است. در مطالعه قبلی ما، افزایش فعالیت آنزیمی از طریق جایگزین نمودن آمینو اسیدهای آلانین و آسپارژین به جای باقیمانده ترئونین در موقعیت 62 گزارش شده بود [18].
در این مطالعه ما علاقهمند بودیم با جهشزایی در باقیمانده کلیدی دیگر در اتصال با سوبسترای FMN قدرت کاتالیتیکی آنزیم را بررسی کنیم. به همین دلیل ابتدا، پیشگویی ساختار سهبعدی با هدف شناسایی باقیماندههای کلیدی انجام شد. از بین چهار باقیمانده کلیدی شناسایی شده، باقیمانده آسپارژین در موقعیت 77 با استفاده از روش جهشزایی هدفمند با فنیل آلانین جایگزین شد. درنهایت قدرت کاتالیتیکی آنزیمهای وحشی و جهشیافته مورد مقایسه قرار گرفت.
مواد و روشها
شناسایی باقیماندههای کلیدی آنزیم فلاوین ردوکتاز DszD جهت اتصال به سوبسترا
توالی آمینو اسیدهای آنزیم DszD در پایگاه NCBI با عدد دسترسی AAC38226.1 موجود است. به منظور شناسایی مولکول همولوگ با شباهت قابل قبول، توالی آنزیم هدف در پایگاه داده پروتئین جستوجو شد [19]. در بین همولوگهای شناساییشده، همولوگهای متصل به سوبسترای FMN انتخاب و همترازی آنها با یکدیگر از طریق ابزار BLAST انجام شد.
مواد شیمیایی، سویه باکتریایی، پلاسمیدها و پرایمرها
DNA ژنومی از سویه باکتریایی رودوکوکوس اریتروپولیس IGTS8 تهیه شد. وکتور کلونینگ pBluescript II KS (+) از فرمنتاز و وکتور بیانی pET-23a (+) از Novagen بودند. DNA پلیمراز، آنزیمهای برشی BamHI و EcoRI، T4 Ligase، کیت استخراج ژل آگارز (Cat. No. 11696505001) و کیت تخلیص محصول RCP Cat. No. 11732668001)) از شرکت Roche آلمان؛ کیت استخراج AND Cat. No. K1014-100)) و کیت تخلیص پلاسمید (Cat. No. K2014-100) از شرکت Qiagen و نشانگرهای پروتئینی و آنتیبادی T7 tag از شرکت فرمنتاز لیتوانی خریداری شد.
تکثیر و همسانهسازی ژن dszD نوع وحشی و جهشیافته
ژن dszD نوع وحشی با استفاده از PCR از طریق پرایمرهای پیشرو و پسرو به ترتیب ATGGATCCATGTCTGACAAGCCGAATGC و GTAGAATTCCTACTATTGACCTAACGGAGTCGG تکثیر شد که به ترتیب دارای جایگاه برش برای آنزیمهای محدودکننده BamHI و EcoRI بودند (نوکلئوتیدهایی که زیر آن خط کشیده شده است، جایگاه برش آنزیمهای محدودکننده را نشان میدهد). ژن جهشیافته dszD با استفاده از روش SOEing-PCR، ایجاد شد [20]. پرایمرهای پیشرو و پسرو برای ایجاد جهش در موقعیت 77 به ترتیب 5/-CGTCTCGTTCTTCATCGCGGAG-3/ و 5/-CTCCGCGATGAAGAACGAGACG-3/ بودند. ژن نوع وحشی و جهشیافته حاصل به طول 600 جفت باز به صورت جداگانه درون وکتور بیانی pET-23a (+) همسانهسازی شدند و سپس به سلولهای E. coli BL21 (DE3) منتقل شدند. صحت همسانهسازی با استفاده از دو آنزیم محدودکننده مذکور و همچنین توالییابی انجام شد. روشهای مولکولی بر اساس پروتکل استاندارد Russelو Sambrook انجام شدند [21].
القای بیان، الکتروفورز ژل آکریلامید و وسترن بلات
وکتورهای بیانی pET-23a حاوی ژنهای وحشی و جهشیافته، هرکدام به صورت جداگانه به میزبان بیانی (E. coli BL21 (DE3 منتقل شدند. میزبانهای نوترکیب در محیط کشت LB در دمای 37 درجه سانتیگراد کشت داده شد تا به چگالی نوری 7/0 رسیدند. به منظور بررسی بیان میزبانهای فوق از محیط کشت حاوی IPTG با غلظت نهایی 1/0 میلیمولار استفاده شد. برای لیز سلولی از بافر نمونه حاوی 80 میلیمولار (6/8 pH)Tris-Hclسدیم دو دسیل سولفات 2 درصد، گلیسرول 10 درصد و معرف برموفنول آبی 2/0 درصد استفاده شد.
جهت مشاهده الگوی پروتئینی، نمونهها بر روی ژلپلیآکریلامید (5/12 درصد) الکتروفورز و توسط محلول کوماسی بلو رنگآمیزی شدند. به منظور اجرای وسترن بلات، پروتئینهای تفکیکشده بر روی ژل در مجاورت با غشای PVDF با شدت جریان 200 میلیآمپر قرار گرفتند. بعد از اتمام انتقال پروتئینها، غشا در محلول BSA غوطهور شد. سپس غشا به داخل محلول آنتیبادی T7 tag و بافر TBS-T به نسبت 1 به 1000 قرار گرفت. پس از شستوشو با بافر فوق، غشا به مدت یک ساعت در محلول حاوی آنتیبادی ضد T7 tag(HRP) و بافر TBS-T به نسبت 1 به 2500 قرار داده شد. درنهایت جهت آشکارسازی پروتئینهای منتقلشده بر روی غشا از محلول سوبسترای آنزیم پراکسیداز شامل دیآمینوبنزیدین 5/0 میلیگرم در میلیلیتر و پراکسید هیدروژن 1/0 درصد در TBS استفاده شد [22].
سنجش قدرت کاتالیتیکی آنزیم فلاوین ردوکتاز DszD
جهت بررسی قدرت کاتالیتیکی آنزیم DszD، ابتدا پروتئینهای بیانشده در محلول حاوی 50 میلیمولار Tris/HCl (pH 7/5)، 140 میکرومولار NADH و 20 میکرومولار FMN حل شدند. سپس جذب نوری آنها در طول موج 340 نانومتر طی اکسیداسیون NADH به NAD در واحد زمان سنجش شد [18]. غلظت پروتئین با استفاده از روش برادفورد با BSA به عنوان استاندارد تعیین شد [23].
یافتهها
جستوجوی توالی آمینو اسید آنزیم فلاوین ردوکتاز DszD در پایگاه داده پروتئینی، مولکولهای همولوگ با ساختمان کریستالوگرافی مشخص را معرفی کرد. مولکولهای همولوگ با بالاترین شباهت ساختاری به آنزیم هدف و متصل به سوبسترای FMN، به عنوان الگوی مناسب جهت شناسایی موقعیتهای کلیدی، انتخاب شدند. نتایج همترازی توالی آمینو اسیدهای آنزیم DszD با مولکولهای همولوگ انتخاب شده، نشان داد جایگاه فعال آنزیم هدف دارای چهار موقعیت کلیدی جهت اتصال به سوبسترای FMN است که عبارتاند از: ترئونین 62، سرین 63، آسپارژین 77 و آلانین 79 (تصویر شماره 1).
تکثیر ژن dszD نوع وحشی و جهشیافته و همسانهسازی آن
تکثیر ژن dszD نوع وحشی با استفاده از پرایمرهای اختصاصی DszD-F و DszD-R انجام شد (تصویر شماره 2. (الف) ستون 1). همچنین ژن dszD جهشیافته در موقعیت 77 با استفاده از پرایمر جهشزا حاصل شد. برای این منظور قطعات آمپلیکون حاصل از PCRهای اول و دوم، تخلیص و به عنوان الگو برای PCRسوم قرار گرفتند (تصویر شماره 2. (الف) ستون 2). پس از هضم آنزیمی وکتور pET-23a (+) و قطعات تکثیرشده نهایی، هرکدام به صورت جداگانه به منظور تولید پلاسمید نوترکیب طی واکنش اتصال به هم متصل شدند. نتایج توالییابی صحت همسانهسازی را تأیید کرد.
پلاسمیدهای نوترکیب حاوی ژن نوع وحشی و جهشیافته هرکدام به صورت جداگانه به سویه بیانیE.coli BL21 (DE3) منتقل شدند. نتایج آزمایشگاهی بیان مناسب ژنهای همسانهسازیشده مدنظر را نشان داد که دارای باند مشخص بر روی ژل پلیآکریلامید با وزن مولکولی 24 کیلو دالتون هستند (تصویر شماره 2. "ب"). آنالیز وسترن بلات، حضور سطح معنیدار بیان آنزیم فلاوین ردوکتاز DszD نوترکیب وحشی و جهشیافته را تأیید کرد (تصویر شماره 2. "ج").
بررسی قدرت کاتالیتیکی آنزیم فلاوین ردوکتاز DszD نوع وحشی و جهشیافته
نتایج مقایسه میانگین قدرت کاتالیتیکی آنزیم فلاوین ردوکتاز DszD نوع وحشی و جهشیافته نشان داد آنزیم جهشیافته دارای قدرت کاتایتیکی به میزان 6±392 یونیت بر میلیگرم است که نسبت به آنزیم نوع وحشی (4±160 یونیت بر میلیگرم) به میزان 5/2 برابر افزایش فعالیت دارد.
بحث
امروزه به دلیل تصویب قوانین سختگیرانه زیستمحیطی، استفاده از روشهای مهندسی ژنتیک جهت حذف اختصاصی گوگرد از سوختهای فسیلی مورد توجه بسیاری از محققین قرار گرفته است. تاکنون در این راستـا پیشرفتهای قابل توجـهی حاصل شده است، بهویژه آنکه در رابطه با بررسی و ارزیابی مکانیسمهای گوگردزدایی باکتریایی دستاوردهای مهمی نیز کسب شده است [24]. اگرچه در اغلب تحقیقاتی که تاکنون انجام شده است، کوششها مبتنی بر استفاده از روشهای میکروبیولوژی و بیوشیمیایی بوده است، آنچه که بیش از همه جلب توجه کرده است، مسیر متـابولیکی و بسیار اختـصاصی 4S در میکروارگانیسم هـوازی رودوکوکوس اریتروپولیس سویه IGTS8 است که بدون آسیب به شبـکه کربنی، قادر به حذف گوگرد از ترکیبات نفتی است [25].
در فرایند 4S، آنزیم فلاوین ردوکتاز DszD به سهم خود یک آنزیم محدودکننده سرعت فرایند گوگردزدایی است و به عنوان آنزیم کلیدی نقش اصلی را به عهده داشته و میزان قدرت آن بر سرعت انتقال اکسیداتیو اثر مستقیم دارد. با توجه به اینکه در صنعت، هدف این است که با صرف انرژی کمتر و زمان کوتاهتر بتوان به راندمان مناسب دست یافت، بنابراین میتوان به آنزیم فلاوین ردوکتاز DszD به عنوان یکی از عوامل کاتالیتیکی مؤثر در زنجیره حذف گوگرد روی آورد. اما از آنجا که قدرت این کاتالیزور زیستی در شرایط عادی پایین است [26]، از طریق ایجاد جهش هدفمند و منطقی در کیفیت آمینو اسیدهای متصل به سوبسـترا و مؤثر در کاتالــیز که در جایگاه فـعال آنزیمی قـرار گرفـته باشند، مـیتوان به مولکول زیسـتی با ویژگیهای مـطلوب و قابلیتهای مــورد انتظار دسـت یافـت [27].
چن و همکاران مولکول جهشیافته جدیدی از آنزیم ایزوپنتیل دی فسفات ایزومراز به وسیله روش ترکیبی جهشزایی هدفمند و جهشزایی تصادفی ایجاد کردند. در این آنزیم، آمینو اسیدهای تیروزین 195، تریپتوفان 256 و لیزین 141 به ترتیب با آمینو اسیدهای فنیل آلانین، سیستئین و هیستیدین جایگزین شدند. نتایج این مطالعه افزایش فعالیت کاتالیتیک آنزیم جهشیافته نسبت آنزیم نوع وحشی به میزان 1/2 برابر را نشان داد. علاوه بر آن افزایش پایداری در pH، ارتقای پایداری دمایی و نیمه عمر طولانیتر به عنوان اثرات دیگر جهش ایجادی گزارش شد [28].
دوان و همکاران نیز مولکولهای موتانت متعددی از آنزیم پولولاناز ایجاد کردند که فعالیت کاتالیتیکی، پایداری دمایی و قدرت اتصال به سوبسترا در آنها نسبت به آنزیم نوع وحشی بهبود یافته بود [29]. در مطالعه قبلی ما، ترئونین موجود در موقعیت 62 آنزیم با آمینو اسید آسپارژین جایگزین شد و به دلیل نزدیکشدن آمینو اسید آسپارژین به حلقه ایزوالکسازین در سوبسترای FMN نسبت به ترئونین، افزایش در سرعت انتقال الکترون و در نتیجه افزایش فعالیت آنزیم فلاوین ردوکتاز DszD گزارش شد [18].
در این مطالعه، فعالیت آنزیمی بعد از ایجاد جهش هدفمند در آمینو اسید آسپارژین موقعیت 77 به عنوان یکی از باقیماندههای کلیدی دیگر در جایگاه فعال آنزیم بررسی شد. نتایج آزمایشگاهی نشان داد که آنزیم جهشیافته در مقایسه با آنزیم نوع وحشی از قدرت کاتالیتیکی بالاتری برخوردار است. در آنزیم جهشیافته مدنظر، زنجیره جانبی قطبی موجود در آسپارژین که دارای گروه آمین و کربنیل است، جایگزین گروه غیرقطبی حلقه بنزنی شده است و توالی آمینو اسیدی ازPhe76-Asn77-Ile78در آنزیم تیپ وحشی به Phe76-Phe77-Ile78 در آنزیم جهشیافته تغییر یافته است.
نتایج سنجش فعالیت بیولوژیک نشان داد فعالیت آنزیم جهشیافته در مقایسه با فعالیت آنزیم نوع وحشی به میزان 5/2 برابر افزایش یافته است. با توجه به اینکه آمینو اسید فنیل آلانین، غیرقطبی و فاقد هرگونه بار اسیدی و بازی است، بنابراین نمیتوان مستقیماً برای آن در اتصال به سوبسترا نقشی قائل شد. از طرفی قرارگرفتن دو آمینو اسید حجیم فنیل آلانین در مجاورت یکدیگر، منجر به تاخوردگی آنها به سمت داخل مولکول شده و میتواند احتمال در معرض قرارگرفتن آمینو اسیدهای قطبی مجاور آنها را افزایش دهد و با ایجاد فضای بازتر در جایگاه فعال آنزیم به جایگیری مناسب و سریعترFMN قطبی کمک کند. از آنجا که منابع متعدد، موقعیت ترئونین 62 را با اهمیت و دارای نقش کلیدی در انتقال مستقیم هیدرید جهت انجام فعالیت اکسیدوردوکتازی آنزیم معرفی کردهاند [18 ،17]، این فرضیه ایجاد میشود که با در معرض قرارگرفتن بیشتر آمینو اسیدهای قطبی، امکان اتصال مناسبتر سوبسترا در جایگاه فعال فراهم شده و درنتیجه فعالیت اکسیدوردوکتازی آنزیم افزایش مییابد.
نتیجهگیری
این مطالعه نشان میدهد که آنزیم مدنظر، پتانسیل مناسبی جهت افزایش قدرت کاتالیتیکی در مسیر 4S دارد. بنابراین، جهش هدفمند در آنزیم فلاوین ردوکتاز DszD و فعالیت آن در سلولهای میزبان نوترکیب میتواند باعث افزایش راندمان فرایند گوگردزدایی با استفاده از سیستم باکتریایی شود. پیشنهاد میشود که مولکول جهشیافته واجد جهش در چندین موقعیت کلیدی، تولید شود و قدرت کاتالیتیکی آن با جهشیافتههای گزارششده، مقایسه شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با کد IR.NIGEB.EC.1398.6.24 A به تأیید کمیته اخلاق پژوهشی پژوهشگاه ملی مهندسی ژنتیک و زیستفناوری رسیده است. این مطالعه فاقد نمونه انسانی و هرگونه شرکتکننده است؛ بنابراین نیازی به رضایتنامه نبود. مطالعه صرفاً بر روی آنزیم صنعتی انجام شده است.
حامی مالی
این مطالعه بدون هرگونه حمایت مالی صورت گرفته است.
مشارکت نویسندگان
مفهومسازی، تحقیق و بررسی، ویراستاری و نهاییسازی نوشته: کلیه نویسندگان.
تعارض منافع
نویسندگان تصریح میکنند هیچگونه تضاد منافعی در این پژوهش وجود ندارد.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |