دوره 23، شماره 1 - ( فروردین و اردیبهشت 1399 )
جلد 23 شماره 1 صفحات 91-82 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mohammadnezhad G, Matin Homayi H, Ghazalian F. Effect of a 6-Week Resistance Training Program on Transforming Growth Factor Beta-1 and Myostatin Genes Expression in Tendons of Extensor Digitorum Longus and Soleus Muscles in Rats. J Arak Uni Med Sci 2020; 23 (1) :82-91
URL: http://jams.arakmu.ac.ir/article-1-6207-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6207-fa.html
محمدنژاد قاسم، متین همائی حسن، غزالیان فرشاد. اثر 6 هفته تمرین مقاومتی بر بیان ژنهای TGF-β1 و میوستاتین در تاندون عضلات EDL و سولئوس موشهای نر ویستار. مجله دانشگاه علوم پزشكي اراك. 1399; 23 (1) :82-91
1- گروه فیزیولوژی ورزشی، دانشکده تربیت بدنی و علوم ورزشی، واحد تهران مرکزی، دانشگاه آزاد اسلامی، تهران، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده تربیت بدنی و علوم ورزشی، واحد تهران مرکزی، دانشگاه آزاد اسلامی، تهران، ایران. ،hasanmatinhomaee@gmail.com
2- گروه فیزیولوژی ورزشی، دانشکده تربیت بدنی و علوم ورزشی، واحد تهران مرکزی، دانشگاه آزاد اسلامی، تهران، ایران. ،
متن کامل [PDF 4103 kb]
(1669 دریافت)
| چکیده (HTML) (5151 مشاهده)
References
Schiaffino S, Reggiani C. Molecular diversity of myofibrillar proteins: Gene regulation and functional significance. Physiol Rev. 1996; 76(2):371-423. [DOI:10.1152/physrev.1996.76.2.371] [PMID]
Davis ME, Gumucio JP, Sugg KB, Bedi A, Mendias CL. MMP inhibition as a potential method to augment the healing of skeletal muscle and tendon extracellular matrix. J Appl Physiol. 2013; 115(6):884-91. [DOI:10.1152/japplphysiol.00137.2013] [PMID] [PMCID]
Kjær M, Langberg H, Heinemeier K, Bayer M, Hansen M, Holm L, et al. From mechanical loading to collagen synthesis, structural changes and function in human tendon. Scandinavian J Med Sci Sports. 2009; 19(4):500-10. [DOI:10.1111/j.1600-0838.2009.00986.x] [PMID]
Mendias CL, Gumucio JP, Bakhurin KI, Lynch EB, Brooks SV. Physiological loading of tendons induces scleraxis expression in epitenon fibroblasts. J Orthop Res. 2012; 30(4):606-12. [DOI:10.1002/jor.21550] [PMID] [PMCID]
McPherron AC, Lawler AM, Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-p superfamily member. Nature. 1997; 387(6628):83. [DOI:10.1038/387083a0] [PMID]
Mendias CL, Bakhurin KI, Faulkner JA. Tendons of myostatin-deficient mice are small, brittle, and hypocellular. Proc Natl Acad Sci. 2008; 105(1):388-93. [DOI:10.1073/pnas.0707069105] [PMID] [PMCID]
Pryce BA, Watson SS, Murchison ND, Staverosky JA, Dünker N, Schweitzer R. Recruitment and maintenance of tendon progenitors by TGFβ signaling are essential for tendon formation. Development. 2009; 136(8):1351-61. [DOI:10.1242/dev.027342] [PMID] [PMCID]
Czarkowska-Paczek B, Zendzian-Piotrowska M, Bartlomiejczyk I, Przybylski J, Gorski J. The effect of acute and prolonged endurance exercise on transforming growth factor-beta1 generation in rat skeletal and heart muscle. J Physiol Pharmacol. 2009; 60(4):157-62. [PMID]
Hittel DS, Axelson M, Sarna N, Shearer J, Huffman KM, Kraus WE. Myostatin decreases with aerobic exercise and associates with insulin resistance. Med Sci Sports Exerc. 2010; 42(11):2023-9. [DOI:10.1249/MSS.0b013e3181e0b9a8] [PMID] [PMCID]
Matsakas A, Friedel A, Hertrampf T, Diel P. Short‐term endurance training results in a muscle‐specific decrease of myostatin mRNA content in the rat. Acta physiologica scandinavica. 2005; 183(3):299-307. [DOI:10.1111/j.1365-201X.2005.01406.x] [PMID]
Gumucio JP, Sugg KB, Mendias CL. TGF-β superfamily signaling in muscle and tendon adaptation to resistance exercise. Exerc Sport Sci Rev. 2015; 43(2):93-9. [DOI:10.1249/JES.0000000000000041] [PMID] [PMCID]
Jaafari Sardoui S, Nikoei R, Sheibani V. The effect of time series of resistance training on TGF-β1 expression and muscle hypertrophy in male wistar rats. J Appl Exerc Physiol. 2015; 11(22):23-32. [DOI:10.22080/JAEP.2016.1205]
Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001; 29(9):e45. [DOI:10.1093/nar/29.9.e45] [PMID] [PMCID]
Heinemeier K, Olesen J, Haddad F, Langberg H, Kjær M, Baldwin K, et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. J Physiol. 2007; 582(3):1303-16. [DOI:10.1113/jphysiol.2007.127639] [PMID] [PMCID]
Yang G, Crawford RC, Wang JH. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 2004; 37(10):1543-50. [DOI:10.1016/j.jbiomech.2004.01.005] [PMID]
Attarzadeh Hosseini SR, Moeinnia N, Motahari Rad M. The effect of two intensities resistance training on muscle growth regulatory myokines in sedentary young women. Obes Medi. 2017; 5:25-8. [DOI:10.1016/j.obmed.2017.01.004]
Matsakas A, Bozzo C, Cacciani N, Caliaro F, Reggiani C, Mascarello F, et al. Effect of swimming on myostatin expression in white and red gastrocnemius muscle and in cardiac muscle of rats. Exp Physiol. 2006; 91(6):983-94. [DOI:10.1113/expphysiol.2006.033571] [PMID]
Carlson CJ, Booth FW, Gordon SE. Skeletal muscle myostatin mRNA expression is fiber-type specific and increases during hindlimb unloading. Am J Physiol. 1999; 277(2):R601-6. [DOI:10.1152/ajpregu.1999.277.2.R601] [PMID]
Wehling M, Cai B, Tidball JG. Modulation of myostatin expression during modified muscle use. FASEB J. 2000; 14(1):103-10. [DOI:10.1096/fasebj.14.1.103] [PMID]
Mendias CL, Lynch EB, Gumucio JP, Flood MD, Rittman DS, Van Pelt DW, et al. Changes in skeletal muscle and tendon structure and function following genetic inactivation of myostatin in rats. J Physiol. 2015; 593(8):2037-52. [DOI:10.1113/jphysiol.2014.287144] [PMID] [PMCID]
متن کامل: (2280 مشاهده)
مقدمه
عضله اسکلتی نقشی مهم در حفظ وضعیت بدن، حرکت، صحبت کردن، تنفس، تأمین حرکت و نیازهای سوختوسازی دارد. از منظر فیزیولوژیکی، عضله اسکلتی بافتی پویاست که قادر است با تحریکات فیزیولوژیک گوناگون ازجمله تمرینات ورزشی سازگاری یابد [1].
بافت تاندون امتداد ماتریکس خارج سلولی (ECM) عضلانی است که به صورت مکانیکی و ساختاری به صورت هماهنگ با عضله با بار مکانیکی سازگاری مییابد [2]. قبلاً تصور میشد که تاندون یک بافت غیرفعال از نظر متابولیک است، اما مطالعات اخیر نشان دادهاند که تاندون نیز مانند عضله اسکلتی، بافتی پویاست و فعالیت سوختوسازی آن با بار مکانیکی افزایش مییابد. به دنبال یک ورزش منفرد، تاندون جذب گلوکز و سنتز کلاژن خود را افزایش میدهد و این حالت 3-2 روز پس از آن همچنان ادامه مییابد [3]. تمرین مقاومتی مزمن به افزایش سطح مقطع CSA و سفتی تاندون منجر میشود؛ این امر به تاندون امکان میدهد بارهای بزرگتری از عضله هایپرتروفی شده را تحمل کرده و انرژی الاستیک را به شیوهای کارآمدتر ذخیره کند [3]. همچنین تمرینات مقاومتی با تکثیر فیبروبلاستها همراه است که در پاسخ به بار مکانیکی کلاژن را سنتز میکنند [4 ،3].
عضله اسکلتی نقشی مهم در حفظ وضعیت بدن، حرکت، صحبت کردن، تنفس، تأمین حرکت و نیازهای سوختوسازی دارد. از منظر فیزیولوژیکی، عضله اسکلتی بافتی پویاست که قادر است با تحریکات فیزیولوژیک گوناگون ازجمله تمرینات ورزشی سازگاری یابد [1].
بافت تاندون امتداد ماتریکس خارج سلولی (ECM) عضلانی است که به صورت مکانیکی و ساختاری به صورت هماهنگ با عضله با بار مکانیکی سازگاری مییابد [2]. قبلاً تصور میشد که تاندون یک بافت غیرفعال از نظر متابولیک است، اما مطالعات اخیر نشان دادهاند که تاندون نیز مانند عضله اسکلتی، بافتی پویاست و فعالیت سوختوسازی آن با بار مکانیکی افزایش مییابد. به دنبال یک ورزش منفرد، تاندون جذب گلوکز و سنتز کلاژن خود را افزایش میدهد و این حالت 3-2 روز پس از آن همچنان ادامه مییابد [3]. تمرین مقاومتی مزمن به افزایش سطح مقطع CSA و سفتی تاندون منجر میشود؛ این امر به تاندون امکان میدهد بارهای بزرگتری از عضله هایپرتروفی شده را تحمل کرده و انرژی الاستیک را به شیوهای کارآمدتر ذخیره کند [3]. همچنین تمرینات مقاومتی با تکثیر فیبروبلاستها همراه است که در پاسخ به بار مکانیکی کلاژن را سنتز میکنند [4 ،3].
با اینکه تغییرات مکانیکی و مورفولوژیکی که در پاسخ به تمرینات مقاومتی در تاندونها رخ میدهد، به خوبی مستند شده است، بااینحال درباره سازوکارهای اساسی سلولی و مولکولی که این پاسخها را تنظیم میکنند، اطلاعات زیادی در دسترس نیست. به نظر میرسد که مسیر پیامرسانی خانواده عامل رشدی تغییرشکلدهنده بتا 1 (TGF-β1) نقش اصلی را در سازگاری تاندون با ورزش مقاومتی ایفا میکند. میوستاتین عضو خانواده بزرگ TGF-β است که بیان آن به طور منفی رشد عضله اسکلتی را تنظیم میکند [5]. هم TGF-β1 و هم میوستاتین تکثیر فیبروبلاست تاندون و سنتز کلاژن نوع I را تحریک میکنند [6 ، 4]. درحالیکه به نظر میرسد پیامرسانی TGF-β1 و میوستاتین برای فراخوانی و حفظ فیبروبلاستهای تاندونی در طول تکامل از اهمیت زیادی برخوردار است [7 ،6].
مطالعات متعددی وجود دارند که توانایی این سایتوکاینها در القای تکثیر فیبروبلاست و سنتز کلاژن نوع I در شرایط آزمایشگاهی را نشان میدهند [2]، بااینحال هنوز نقش این مسیرهای پیامرسانی در رشد و ترمیم تاندون آزمودنی بالغ با تردیدهایی روبهرو است. در بیشتر مطالعات صورتگرفته در زمینه سازگاریهای ناشی از تمرینات ورزشی، بیشتر خود عضلات اسکلتی مد نظر بوده [10-8] و به سازگاریهای تاندونی چندان توجه نشده است. بر اساس سوابق پژوهش، مطالعات آزمایشگاهی روی فیبروبلاستهای تاندون بالغ و مطالعات سنتز کلاژن در آزمودنیهای بالغ در پاسخ به تمرین مقاومتی، تصور بر این است که TGF-β1 و میوستاتین نقش مهمی در رشد و سازگاری تاندونهای بالغ به تمرین مقاومتی ایفا میکنند [11]؛ بنابراین این مطالعه با هدف بررسی اثر 6 هفته تمرین مقاومتی بر بیان ژنهای TGF-β1 و میوستاتین در تاندون عضلات تند و کند انقباض موشهای نر ویستار انجام شد.
روش تحقیق
پژوهش حاضر از نوع تجربی است که به شیوه آزمایشگاهی انجام شد. آزمودنیهای تحقیق حاضر تعداد 12 سر رت نر بالغ نژاد ویستار 8 هفتهای با میانگین وزنی 20±195 گرم بودند که از انستیتو پاستور ایران تهیه شد. رتها در دمای محیطی 3±22 درجه سانتیگراد، رطوبت حدود 45 درصد و چرخه روشنایی/تاریکی 12:12 ساعت نگهداری شدند، طوریکه در دسترسی به آب و غذای استاندارد محدودیتی نداشته باشند. بعد از یک هفته آشناسازی با محیط نگهداری، رتها به روش تصادفی ساده به 2 گروه تقسیم شدند: گروه تمرین (تعداد =6 سر) و گروه شاهد (تعداد =6 سر)؛ گروه ورزش به مدت 6 هفته تمرین مقاومتی را اجرا کردند.
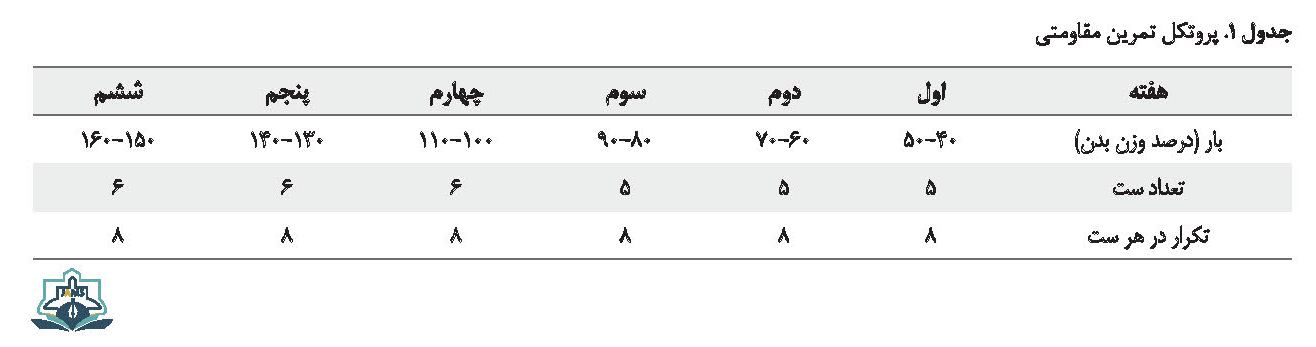
رتهای گروه تمرین مقاومتی به منظور آشناسازی با تمرین به مدت 3 روز آموزش داده شدند؛ سپس پروتکل تمرین مقاومتی به مدت 6 هفته، 5 روز در هفته بر حیوانات گروه تمرین اعمال شد. تمرینات مقاومتی شامل بالا رفتن از نردبان یک متری به فاصله میلههای 2 سانتیمتری و شیب 85 درجه، محققساخته و حمل وزنهای بود که به دم رتها آویزان میشد. در هفته اول میزان وزنههای بسته شده به رتها 40 تا 50 درصد وزن بدن آنها بود که بهتدریج افزایش و به حدود 160 درصد وزن بدن در هفته ششم رسید. افزایش در بار تمرین در طول پروتکل تمرینی از طریق دستکاری وزنه جابهجا شده، تکرار در هر ست و تعداد ستها اعمال شد. تعداد تکرارها در هر ست، 8 تکرار؛ فاصله استراحت بین ستها 2 دقیقه و فاصله استراحت بین تکرارها 20 – 10 ثانیه بود. جزئیات پروتکل تمرینی در جدول شماره 1 گزارش شده است [12].
48 ساعت بعد از آخرین جلسه تمرینی، تمامی رتها از طریق قرار گرفتن در ظرف حاوی اتر بیهوش شدند؛ سپس برش در ناحیه شکم و قفسه سینه ایجاد شد و حیوانات با کشیدن خون به وسیله سرنگ مستقیماً از قلب کشته شدند. در مرحله بعد، تاندون عضلات سولئوس (SOL) و بازکننده بلند انگشتان (EDL) پای راست آنها بلافاصله با دقت استخراج و در دمای منفی 80 درجه سانتیگراد برای سنجشهای بعدی نگهداری شد.
به منظور استخراج RNA تام از بافت تاندون هموژنشده، 1 میلیلیتر ترایزول (Invitrogen, CN 15596018, USA) به 100 میلیگرم بافت اضافه و پس از مخلوط کردن کامل به مدت 15 دقیقه در دمای اتاق انکوبه شد؛ سپس 400 میکرولیتر کلروفرم سرد (Merek, CAS 67-66-3 102445, Germany) به نمونه اضافه و به مدت 15 ثانیه مخلوط شدند. محلول در دمای 4 درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 15 دقیقه سانتریفیوژ شد. مایع حاوی RNA به میکروتیوب دیگری انتقال داده شد، سپس 500 میکرولیتر اتانول (Merek, CAS 64-17-5 107017, Germany) به محلول RNA اضافه شد و به مدت 24 ساعت در دمای منفی 20 درجه سانتیگراد نگهداری شد. این محلول نیز پس از 24 ساعت به مدت 15 دقیقه (دمای 4 درجه سانتیگراد، 12000 دور در دقیقه) سانتریفیوژ شد. مایع رویی با دقت خارج و 1 میلیلیتر اتانول خالص سرد به رسوب RNA اضافه شد و سپس به مدت 5 دقیقه (در دمای 4 درجه با 7500 دور در دقیقه) سانتریفیوژ شد.
در ادامه، مایع رویی بهدقت خارج و رسوب RNA با 100 میکرولیتر ایلوشن بافر (Sigma Aldrich, H5413, Germany) رقیق شد. تمام مراحل استخراج زیر هود و با مواد و وسایل کاملاً استریل انجام گرفت. در پایان، غلظت و نسبت جذبی نمونهها با استفاده از دستگاه اسپکتوفتومتر (Eppendorf, Germany) ارزیابی و نسبت جذبی 260 به 280 بین 8/1 -6/1 به عنوان تخلیص مطلوب تعریف شد. برای اطمینان بیشتر از صحت تخلیص RNA، تعدادی از RNAs تخلیصشده به طور تصادفی روی ژل آگارز 5/1 درصد الکتروفورز شد.
پس از استخراج RNA با خلوص و غلظت بالا، مراحل سنتز cDNA مطابق پروتکل شرکت سازنده (high-capacity cDNA reverse transcription kit) انجام شد. ابتدا RNA، پرایمر و آب با هم ترکیب شدند و محلول به مدت 5 دقیقه در دمای 65 درجه سانتیگراد انکوبه شد، سپس محلول به مدت 2 دقیقه روی یخ قرار گرفت. پس از آن enzyme mix و reaction buffer به محلول اضافه شدند. محلول در 3 مرحله متوالی انکوبه شد: مرحله اول به مدت 10 دقیقه در دمای 25 درجه سانتیگراد؛ مرحله دوم به مدت 30 دقیقه در دمای 42 درجه سانتیگراد و مرحله سوم به مدت 5 ثانیه در دمای 8 درجه سانتیگراد. درنهایت، cDNA سنتز شده در دمای منفی 80 درجه سانتیگراد ذخیره شد. تمام مراحل انجام کار روی یخ، زیر هود و با استفاده از وسایل RNase free انجام شد.
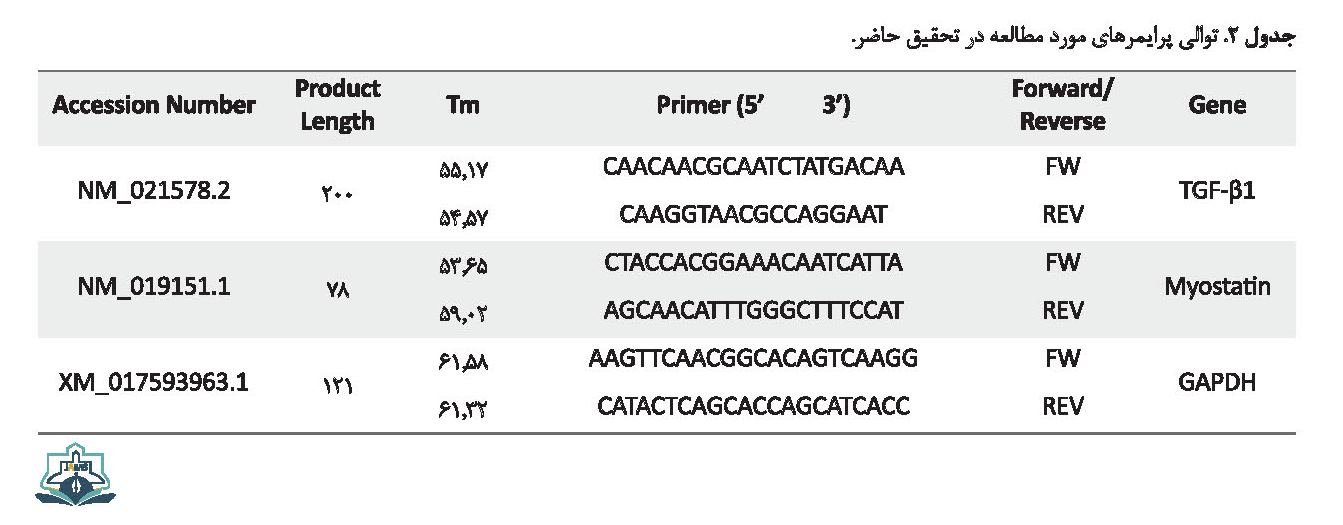
برای اندازهگیری سطوح بیان mRNA از روش کمّی Real time-PCR استفاده شد. در ابتدای کار میزان غلظت بهینه cDNA و همچنین پرایمرهای مربوط به هر ژن با استفاده از آزمایش سریال غلظت برای هر کدام به طور جداگانه مشخص شد، طوریکه کمترین میزان دایمر و بهترین Ct مشاهده شود. Real time-PCR با استفاده از RealQ Plus 2x Master Mix Green شرکت AMPLIQON و با استفاده از غلظت 250 نانوگرم از cDNA انجام گرفت. شرکت پیشگام (ایران) توالی پرایمرهای مربوط به متغیرهای مورد مطالعه را بر اساس اطلاعات این ژنها در بانک ژنی NCBI طراحی کرد (جدول شماره 2).
مطالعات متعددی وجود دارند که توانایی این سایتوکاینها در القای تکثیر فیبروبلاست و سنتز کلاژن نوع I در شرایط آزمایشگاهی را نشان میدهند [2]، بااینحال هنوز نقش این مسیرهای پیامرسانی در رشد و ترمیم تاندون آزمودنی بالغ با تردیدهایی روبهرو است. در بیشتر مطالعات صورتگرفته در زمینه سازگاریهای ناشی از تمرینات ورزشی، بیشتر خود عضلات اسکلتی مد نظر بوده [10-8] و به سازگاریهای تاندونی چندان توجه نشده است. بر اساس سوابق پژوهش، مطالعات آزمایشگاهی روی فیبروبلاستهای تاندون بالغ و مطالعات سنتز کلاژن در آزمودنیهای بالغ در پاسخ به تمرین مقاومتی، تصور بر این است که TGF-β1 و میوستاتین نقش مهمی در رشد و سازگاری تاندونهای بالغ به تمرین مقاومتی ایفا میکنند [11]؛ بنابراین این مطالعه با هدف بررسی اثر 6 هفته تمرین مقاومتی بر بیان ژنهای TGF-β1 و میوستاتین در تاندون عضلات تند و کند انقباض موشهای نر ویستار انجام شد.
روش تحقیق
پژوهش حاضر از نوع تجربی است که به شیوه آزمایشگاهی انجام شد. آزمودنیهای تحقیق حاضر تعداد 12 سر رت نر بالغ نژاد ویستار 8 هفتهای با میانگین وزنی 20±195 گرم بودند که از انستیتو پاستور ایران تهیه شد. رتها در دمای محیطی 3±22 درجه سانتیگراد، رطوبت حدود 45 درصد و چرخه روشنایی/تاریکی 12:12 ساعت نگهداری شدند، طوریکه در دسترسی به آب و غذای استاندارد محدودیتی نداشته باشند. بعد از یک هفته آشناسازی با محیط نگهداری، رتها به روش تصادفی ساده به 2 گروه تقسیم شدند: گروه تمرین (تعداد =6 سر) و گروه شاهد (تعداد =6 سر)؛ گروه ورزش به مدت 6 هفته تمرین مقاومتی را اجرا کردند.
رتهای گروه تمرین مقاومتی به منظور آشناسازی با تمرین به مدت 3 روز آموزش داده شدند؛ سپس پروتکل تمرین مقاومتی به مدت 6 هفته، 5 روز در هفته بر حیوانات گروه تمرین اعمال شد. تمرینات مقاومتی شامل بالا رفتن از نردبان یک متری به فاصله میلههای 2 سانتیمتری و شیب 85 درجه، محققساخته و حمل وزنهای بود که به دم رتها آویزان میشد. در هفته اول میزان وزنههای بسته شده به رتها 40 تا 50 درصد وزن بدن آنها بود که بهتدریج افزایش و به حدود 160 درصد وزن بدن در هفته ششم رسید. افزایش در بار تمرین در طول پروتکل تمرینی از طریق دستکاری وزنه جابهجا شده، تکرار در هر ست و تعداد ستها اعمال شد. تعداد تکرارها در هر ست، 8 تکرار؛ فاصله استراحت بین ستها 2 دقیقه و فاصله استراحت بین تکرارها 20 – 10 ثانیه بود. جزئیات پروتکل تمرینی در جدول شماره 1 گزارش شده است [12].
48 ساعت بعد از آخرین جلسه تمرینی، تمامی رتها از طریق قرار گرفتن در ظرف حاوی اتر بیهوش شدند؛ سپس برش در ناحیه شکم و قفسه سینه ایجاد شد و حیوانات با کشیدن خون به وسیله سرنگ مستقیماً از قلب کشته شدند. در مرحله بعد، تاندون عضلات سولئوس (SOL) و بازکننده بلند انگشتان (EDL) پای راست آنها بلافاصله با دقت استخراج و در دمای منفی 80 درجه سانتیگراد برای سنجشهای بعدی نگهداری شد.
به منظور استخراج RNA تام از بافت تاندون هموژنشده، 1 میلیلیتر ترایزول (Invitrogen, CN 15596018, USA) به 100 میلیگرم بافت اضافه و پس از مخلوط کردن کامل به مدت 15 دقیقه در دمای اتاق انکوبه شد؛ سپس 400 میکرولیتر کلروفرم سرد (Merek, CAS 67-66-3 102445, Germany) به نمونه اضافه و به مدت 15 ثانیه مخلوط شدند. محلول در دمای 4 درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 15 دقیقه سانتریفیوژ شد. مایع حاوی RNA به میکروتیوب دیگری انتقال داده شد، سپس 500 میکرولیتر اتانول (Merek, CAS 64-17-5 107017, Germany) به محلول RNA اضافه شد و به مدت 24 ساعت در دمای منفی 20 درجه سانتیگراد نگهداری شد. این محلول نیز پس از 24 ساعت به مدت 15 دقیقه (دمای 4 درجه سانتیگراد، 12000 دور در دقیقه) سانتریفیوژ شد. مایع رویی با دقت خارج و 1 میلیلیتر اتانول خالص سرد به رسوب RNA اضافه شد و سپس به مدت 5 دقیقه (در دمای 4 درجه با 7500 دور در دقیقه) سانتریفیوژ شد.
در ادامه، مایع رویی بهدقت خارج و رسوب RNA با 100 میکرولیتر ایلوشن بافر (Sigma Aldrich, H5413, Germany) رقیق شد. تمام مراحل استخراج زیر هود و با مواد و وسایل کاملاً استریل انجام گرفت. در پایان، غلظت و نسبت جذبی نمونهها با استفاده از دستگاه اسپکتوفتومتر (Eppendorf, Germany) ارزیابی و نسبت جذبی 260 به 280 بین 8/1 -6/1 به عنوان تخلیص مطلوب تعریف شد. برای اطمینان بیشتر از صحت تخلیص RNA، تعدادی از RNAs تخلیصشده به طور تصادفی روی ژل آگارز 5/1 درصد الکتروفورز شد.
پس از استخراج RNA با خلوص و غلظت بالا، مراحل سنتز cDNA مطابق پروتکل شرکت سازنده (high-capacity cDNA reverse transcription kit) انجام شد. ابتدا RNA، پرایمر و آب با هم ترکیب شدند و محلول به مدت 5 دقیقه در دمای 65 درجه سانتیگراد انکوبه شد، سپس محلول به مدت 2 دقیقه روی یخ قرار گرفت. پس از آن enzyme mix و reaction buffer به محلول اضافه شدند. محلول در 3 مرحله متوالی انکوبه شد: مرحله اول به مدت 10 دقیقه در دمای 25 درجه سانتیگراد؛ مرحله دوم به مدت 30 دقیقه در دمای 42 درجه سانتیگراد و مرحله سوم به مدت 5 ثانیه در دمای 8 درجه سانتیگراد. درنهایت، cDNA سنتز شده در دمای منفی 80 درجه سانتیگراد ذخیره شد. تمام مراحل انجام کار روی یخ، زیر هود و با استفاده از وسایل RNase free انجام شد.
برای اندازهگیری سطوح بیان mRNA از روش کمّی Real time-PCR استفاده شد. در ابتدای کار میزان غلظت بهینه cDNA و همچنین پرایمرهای مربوط به هر ژن با استفاده از آزمایش سریال غلظت برای هر کدام به طور جداگانه مشخص شد، طوریکه کمترین میزان دایمر و بهترین Ct مشاهده شود. Real time-PCR با استفاده از RealQ Plus 2x Master Mix Green شرکت AMPLIQON و با استفاده از غلظت 250 نانوگرم از cDNA انجام گرفت. شرکت پیشگام (ایران) توالی پرایمرهای مربوط به متغیرهای مورد مطالعه را بر اساس اطلاعات این ژنها در بانک ژنی NCBI طراحی کرد (جدول شماره 2).
برنامه Real time-PCR شامل واسرشت اولیه در دمای 95 درجه سانتیگراد و به مدت10 دقیقه، واسرشت در هر سیکل PCR در دمای 95 درجه سانتیگراد به مدت 15 ثانیه و با توجه به دمای اتصال پرایمرها هر سیکل به مدت 30 ثانیه (40 سیکل) در نظر گرفته شد. نمودار دمای ذوب برای بررسی صحت واکنشهای انجامشده، به صورت اختصاصی برای هر ژن و در هر بار از واکنش به همراه نمودار کنترل منفی برای بررسی وجود آلودگی در هر واکنش ارزیابی شد. از ژن گلیسرآلدهید-3-فسفات دهیدروژناز (GAPDH) به عنوان ژن کنترل استفاده و میزان بیان ژن مورد نظر با فرمول ΔΔCT-2 محاسبه شد [13].
برای بررسی طبیعی بودن توزیع دادهها از آزمون کولموگروف-اسمیرنف (KS) استفاده شد. به منظور تحلیل دادههای بهدستآمده از آزمون t مستقل استفاده شد. به معنیداری بین متغیرها در سطح 05/0≤P توجه شد. برای تجزیهوتحلیل دادهها، از نرمافزار 16 SPSS و برای ترسیم نمودارها از نرمافزار 2016 Excel استفاده شد.
یافتهها
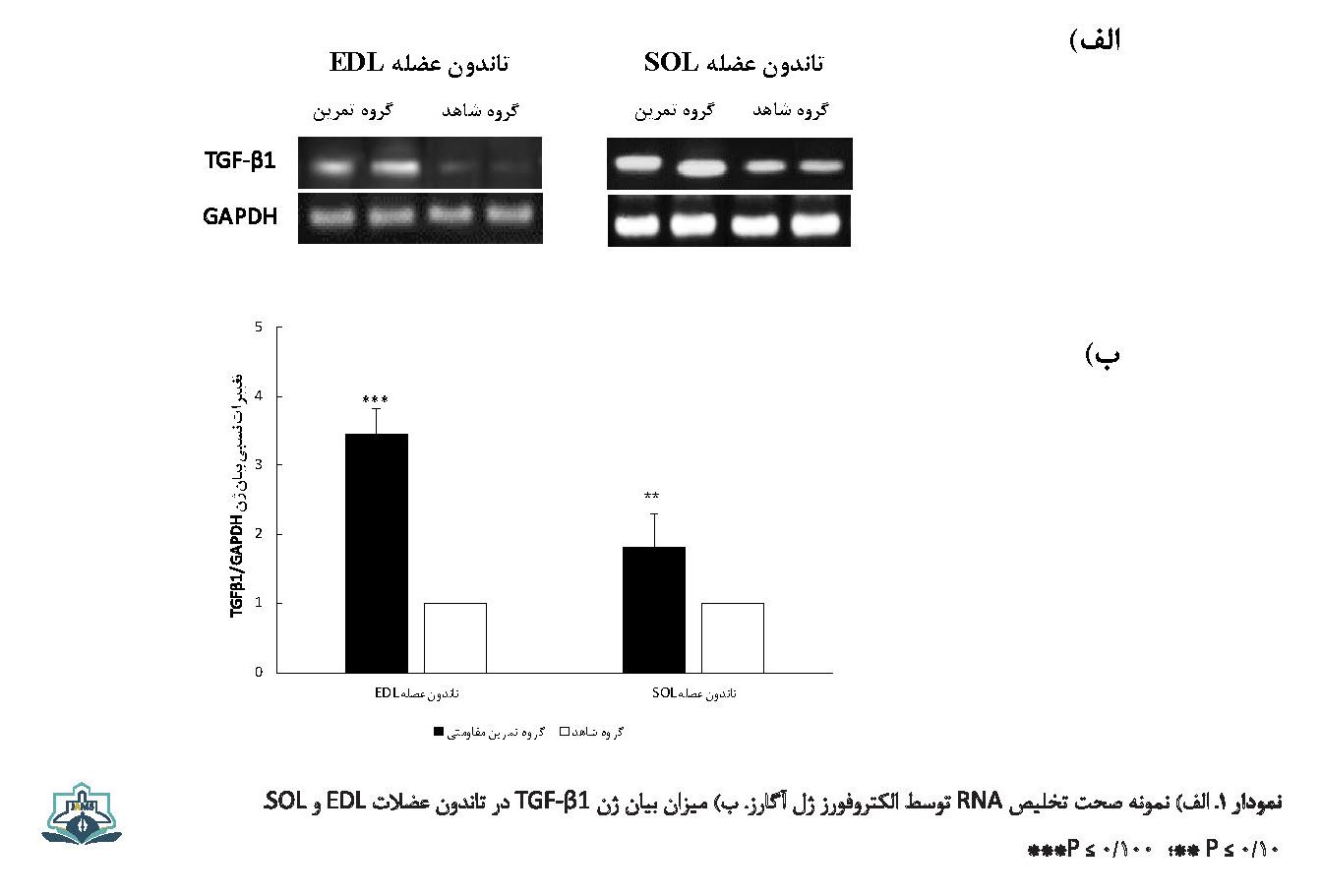
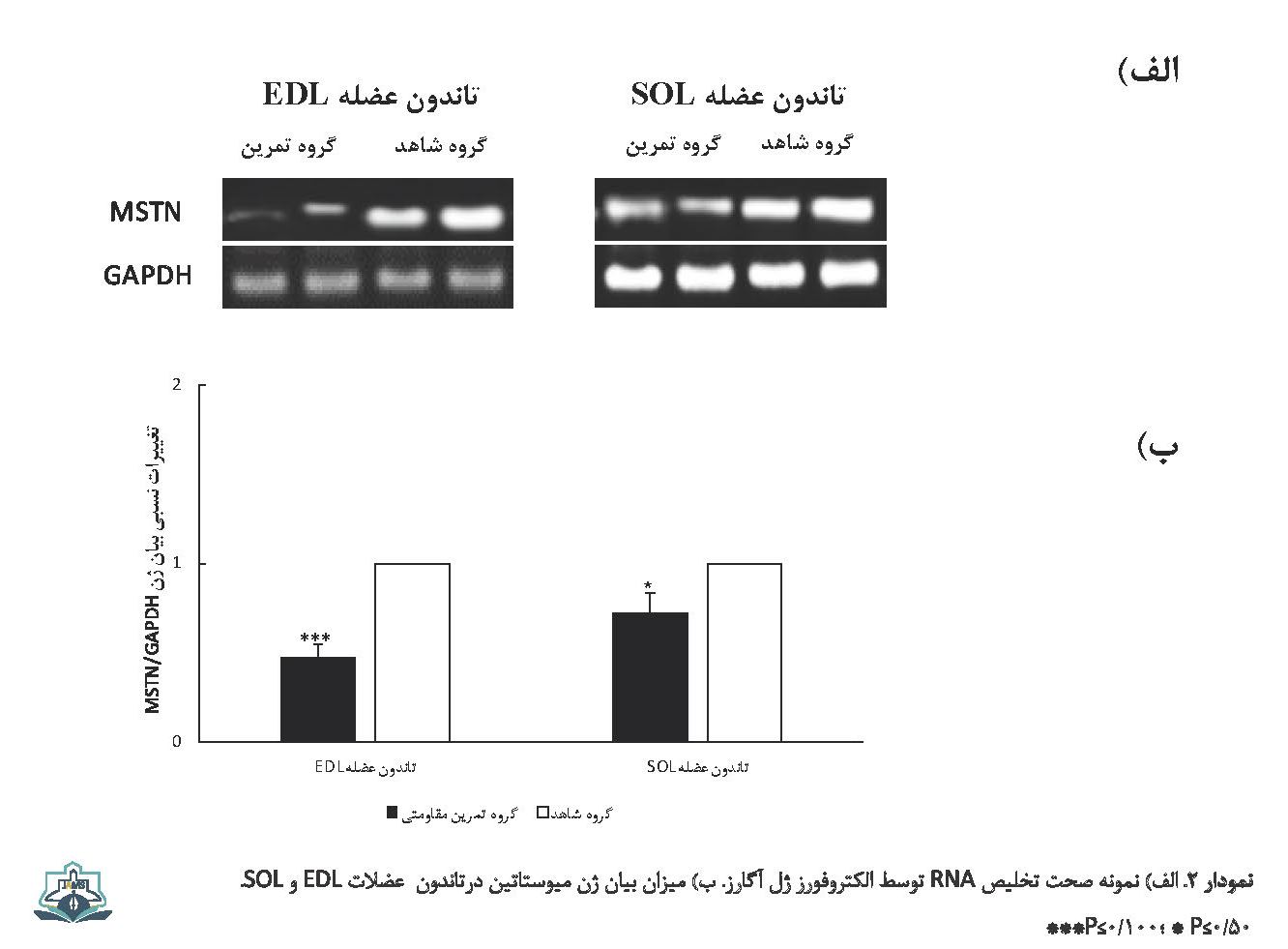
نتایج نشان داد که بین مقادیر mRNA ژنهای TGF-β1 و میوستاتین تاندون عضلات EDL و سولئوس گروه تمرین مقاومتی در مقایسه با گروه شاهد تفاوت معنیداری وجود دارد. بیان mRNA ژن TGF-β1 تاندون عضلات EDL (0/04±0/14= گروه شاهد در مقایسه با 0/14±0/48= گروه تمرین مقاومتی، 0/001≥P) و سولئوس (0/14±0/17 = گروه شاهد در مقایسه با 0/08±02/32 = گروه تمرین مقاومتی، 0/01≥P) به طور معنیداری افزایش یافت، درحالیکه بیان mRNA ژن میوستاتین تاندون عضلات EDL (07/0±0/56 = گروه شاهد در مقایسه با 0/1±0/27 = گروه تمرین مقاومتی، 0/001≥P) و سولئوس (005±0/29 = گروه شاهد در مقایسه با 0/07±0/21 = گروه تمرین مقاومتی، 0/05≥P) به طور معنیداری کاهش نشان داد (تصویر شماره 1 و 2).
برای بررسی طبیعی بودن توزیع دادهها از آزمون کولموگروف-اسمیرنف (KS) استفاده شد. به منظور تحلیل دادههای بهدستآمده از آزمون t مستقل استفاده شد. به معنیداری بین متغیرها در سطح 05/0≤P توجه شد. برای تجزیهوتحلیل دادهها، از نرمافزار 16 SPSS و برای ترسیم نمودارها از نرمافزار 2016 Excel استفاده شد.
یافتهها
نتایج نشان داد که بین مقادیر mRNA ژنهای TGF-β1 و میوستاتین تاندون عضلات EDL و سولئوس گروه تمرین مقاومتی در مقایسه با گروه شاهد تفاوت معنیداری وجود دارد. بیان mRNA ژن TGF-β1 تاندون عضلات EDL (0/04±0/14= گروه شاهد در مقایسه با 0/14±0/48= گروه تمرین مقاومتی، 0/001≥P) و سولئوس (0/14±0/17 = گروه شاهد در مقایسه با 0/08±02/32 = گروه تمرین مقاومتی، 0/01≥P) به طور معنیداری افزایش یافت، درحالیکه بیان mRNA ژن میوستاتین تاندون عضلات EDL (07/0±0/56 = گروه شاهد در مقایسه با 0/1±0/27 = گروه تمرین مقاومتی، 0/001≥P) و سولئوس (005±0/29 = گروه شاهد در مقایسه با 0/07±0/21 = گروه تمرین مقاومتی، 0/05≥P) به طور معنیداری کاهش نشان داد (تصویر شماره 1 و 2).
بحث
مطالعه حاضر با هدف بررسی اثر 6 هفته تمرین مقاومتی بر بیان ژنهای TGF-β1 و میوستاتین در تاندون عضلات تند و کند انقباض موشهای نر ویستار انجام شد. نتایج مطالعه حاضر نشان داد که به دنبال 6 هفته برنامه تمرین مقاومتی، میزان بیان mRNA ژن TGF-β1 در هر دو عضله EDL و سولئوس به شکل معنیداری افزایش مییابد. از سوی دیگر، 6 هفته برنامه تمرین مقاومتی موجب کاهش چشمگیر میزان بیان mRNA ژن میوستاتین در عضلات EDL و سولئوس شد.
بررسی متون حاکی از آن است که بیشتر مطالعات صورتگرفته در این حوزه به پاسخ و سازگاریهای عضلات اسکلتی به تمرین ورزشی متمرکز شدهاند و به بافت تاندون چندان توجه نشده است. این امر مقایسه یافتههای مطالعه حاضر با پژوهشهای پیشین را دشوار میسازد. باوجوداین، هنیمیر و همکاران (2007) افزایش سطوح mRNA ژن TGF-β1 و کلاژنهای نوع I و III در عضله دوقلوی میانی و تاندون آشیل به دنبال انجام انقباضات ایزومتریک، کانسنتریک و اکسنتریک از طریق تحریک عصب سیاتیک به مدت 4 روز را گزارش کردند [14]؛ همچنین در تحقیق دیگری نشان داده شد که انجام تمرین استقامتی طولانیمدت باعث افزایش قابلتوجهی درmRNA ژن TGF-β1 در عضله سولئوس شده است [3].
مطالعه حاضر با هدف بررسی اثر 6 هفته تمرین مقاومتی بر بیان ژنهای TGF-β1 و میوستاتین در تاندون عضلات تند و کند انقباض موشهای نر ویستار انجام شد. نتایج مطالعه حاضر نشان داد که به دنبال 6 هفته برنامه تمرین مقاومتی، میزان بیان mRNA ژن TGF-β1 در هر دو عضله EDL و سولئوس به شکل معنیداری افزایش مییابد. از سوی دیگر، 6 هفته برنامه تمرین مقاومتی موجب کاهش چشمگیر میزان بیان mRNA ژن میوستاتین در عضلات EDL و سولئوس شد.
بررسی متون حاکی از آن است که بیشتر مطالعات صورتگرفته در این حوزه به پاسخ و سازگاریهای عضلات اسکلتی به تمرین ورزشی متمرکز شدهاند و به بافت تاندون چندان توجه نشده است. این امر مقایسه یافتههای مطالعه حاضر با پژوهشهای پیشین را دشوار میسازد. باوجوداین، هنیمیر و همکاران (2007) افزایش سطوح mRNA ژن TGF-β1 و کلاژنهای نوع I و III در عضله دوقلوی میانی و تاندون آشیل به دنبال انجام انقباضات ایزومتریک، کانسنتریک و اکسنتریک از طریق تحریک عصب سیاتیک به مدت 4 روز را گزارش کردند [14]؛ همچنین در تحقیق دیگری نشان داده شد که انجام تمرین استقامتی طولانیمدت باعث افزایش قابلتوجهی درmRNA ژن TGF-β1 در عضله سولئوس شده است [3].
سازوکارهایی که در طول تمرینات ورزشی بار مکانیکی را به افزایش سطوح کلاژن در واحد عضله-تاندون مرتبط میکنند، هنوز به طور کامل شناخته نشدهاند. بااینحال، شواهد موجود نشاندهنده آن است که TGF-β1 واسطه اصلی القای سنتز کلاژن در فیبروبلاستها از طریق بار مکانیکی بوده [14] و چنین نقشی برای TGF-β1 در تاندونها نیز پیشنهاد شده است [15]. افزایش بالای 245 درصدی میزان بیان mRNA ژن TGF-β1 در تاندون عضله EDL در برابر افزایش 81 درصدی آن در تاندون عضله سولئوس که در مطالعه حاضر مشاهده شد، به احتمال زیاد حاکی از درگیری بالاتر عضلات تند انقباض در تمرینات مقاومتی است که موجب ایجاد سازگاریهای بیشتر در بافت کلاژنی و تحمل نیروی بالاتر وارده از سوی عضله تند انقباض به تاندون میشود.
در مطالعه حاضر، تمرینات مقاومتی باعث کاهش سطوح پایه بیان mRNA ژن میوستاتین در تاندون عضلات EDL و سولئوس شد. کاهش سطوح سرمی و عضلانی میوستاتین به دنبال تمرینات ورزشی در بیشتر مطالعات گزارش شده است [16 ،10 ،9]؛ بااینحال، بر اساس جستجوهای ما تنها مطالعهای که تغییرات میوستاتین در اثر سازگاری ورزشی در تاندون را اندازهگیری کرده است، عدم تغییر سطوح بیان mRNA ژن میوستاتین در تاندون آشیل و کاهش آن در عضله دوقلوی میانی به دنبال انجام تمرینات مقاومتی کوتاهمدت را نشان داده است [14]. از دلایل تفاوت در یافتهها میتوان به مدت و نوع پروتکل تمرین مقاومتی اشاره کرد. در مطالعه مذکور از تحریک عصب سیاتیک به منظور اعمال برنامه تمرین مقاومتی در رتها استفاده شده بود که تنها 4 روز ادامه داشت، درحالیکه برنامه تمرین مقاومتی استفادهشده در مطالعه حاضر بالابردن وزنه از نردبان به مدت 6 هفته بود.
در تحقیقی جالب گزارش شده است که نوع ورزش عامل اصلی تعیینکننده برای فراوانی رونویسی RNA میوستاتین به شمار نمیرود [17]. عطارزاده حسینی و همکاران (1395) کاهش سطوح مایوستاتین سرمی در زنان را به دنبال 8 هفته تمرینات مقاومتی با شدت بالا گزارش کردند [16]. هیتل و همکاران (2010) تأثیر ششماه تمرین هوازی متوسط را بر مقادیر میوستاتین عضلانی و پلاسمایی مردان میانسال بررسی و کاهش متوسط 37 درصدی میوستاتین عضلانی و پلاسمایی را بعد از تمرین گزارش کردهاند [9]. در تحقیقی دیگر، ماتساکاس و همکاران (2005) نتایج متفاوتی را در بیان ژن میوستاتین در پاسخ به تمرین استقامتی در بافتهای مختلف گزارش کردهاند. در عضله دوقلو موشهای صحرایی تمرینکرده در بیان ژن میوستاتین کاهش 65 درصدی گزارش شد، درحالیکه در عضله پهن خارجی این کاهش متوسط و به مقدار 49 درصد بود و در عضله نعلی بین موشهای تمرینکرده و بیتمرین تغییری مشاهده نشد [10].
درحقیقت، شواهد زیادی از این ایده حمایت میکنند که تنظیم میوستاتین با توجه به نوع تارهای عضلانی ویژگی حساسیت و پاسخ دقیق تری دارند و بهشدت با ایزوفرم IIb زنجیره سنگین میوزین عضله ارتباط دارد [18] و غلظت بالای پروتئین میوستاتین در عضله تندانقباض در مقایسه با تارهای کندانقباض مشاهده شده است [19]. این گزارشها میتواند نتایج حاصل از مطالعه حاضر مبنی بر کاهش بالای 53 درصدی بیان mRNA ژن میوستاتین در عضله EDL در مقایسه با کاهش اندک 28 درصدی بیان آن در عضله سولئوس را توجیه کند.
میوستاتین علاوه بر اینکه اندازه، نوع و انقباضپذیری عضله را کنترل میکند، ترکیب ECM عضله و تاندون را احتمالاً از طریق القای بیان کلاژن نوع I تنظیم میکند [6]. بااینحال، مندیاس و همکاران (2015) نشان دادهاند که غیرفعالسازی ژنتیکی میوستاتین در رتها ضمن افزایش حجم عضلانی، تأثیر منفی بر ویژگیهای مکانیکی تاندون ندارد [20]. بر اساس نتایج حاصل از مطالعه حاضر و با در نظر گرفتن گزارش مندیاس و همکاران (2015) به نظر میرسد که سازگاریهای تاندونی ناشی از تمرینات مقاومتی بیشتر متأثر از پیامرسانی TGF-β1 بوده و میوستاتین نقش چندانی در این زمینه ایفا نمیکند. البته باید توجه داشت که جمعآوری نمونهها در مطالعه حاضر، 48 ساعت بعد از آخرین جلسه تمرینی صورت گرفته و این احتمال وجود دارد که سطح بیان میوستاتین در ساعات اولیه بعد از تمرین افزایش داشته است که این موضوع سبب سازگاریهای تاندونی میشود. عدم اندازهگیری سطوح بیان میوستاتین به صورت سریال زمانی که یکی از محدودیتهای مطالعه حاضر به شمار میرود، این تفسیر را دشوار میکند.
نتیجهگیری
بهطورکلی، تمرین مقاومتی باعث تنظیم مثبت سطوح پایه mRNA ژن TGF-β1 و تنظیم منفی سطوح پایه mRNA ژن میوستاتین در تاندون عضلات تند و کند انقباض میشود و این اثرات در عضله تندانقباض در مقایسه با عضله کندانقباض به طور قابلتوجهی بیشتر است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
همه مراحل مربوط به حیوانات با توجه به دستورالعمل اخلاقی و مجوز معاونت پژوهشی دانشگاه آزاد اسلامی واحد تهران مرکزی با شماره IR.IAU.PS.REC.1398.296 انجام شد.
حامی مالی
مقاله حاضر برگرفته از رساله دکتری نویسنده اول آقای محمدنژاد، گروه تربیت بدنی و علوم ورزشی، دانشگاه آزاد اسلامی واحد تهران مرکزی است.
مشارکت نویسندگان
تعریف موضوع و بیان مسأله: تمام نویسندگان؛ روش پژوهش: قاسم محمدنژاد؛ تحلیل دادهها: قاسم محمدنژاد؛ نگارش متن و بازبینی: تمام نویسندگان
تعارض منافع
نویسندگان مقاله هیچگونه تعارضی در منافع اعلام نکردند.
تشکر و قدردانی
از پرسنل محترم بخش فیزیولوژی و فارماکولوژی انستیتو پاستور ایران و همچنین مسئول محترم حیوانخانه دانشگاه تربیت مدرس به خاطر همکاری در اجرای این مطالعه کمال تشکر و قدردانی را داریم.
در مطالعه حاضر، تمرینات مقاومتی باعث کاهش سطوح پایه بیان mRNA ژن میوستاتین در تاندون عضلات EDL و سولئوس شد. کاهش سطوح سرمی و عضلانی میوستاتین به دنبال تمرینات ورزشی در بیشتر مطالعات گزارش شده است [16 ،10 ،9]؛ بااینحال، بر اساس جستجوهای ما تنها مطالعهای که تغییرات میوستاتین در اثر سازگاری ورزشی در تاندون را اندازهگیری کرده است، عدم تغییر سطوح بیان mRNA ژن میوستاتین در تاندون آشیل و کاهش آن در عضله دوقلوی میانی به دنبال انجام تمرینات مقاومتی کوتاهمدت را نشان داده است [14]. از دلایل تفاوت در یافتهها میتوان به مدت و نوع پروتکل تمرین مقاومتی اشاره کرد. در مطالعه مذکور از تحریک عصب سیاتیک به منظور اعمال برنامه تمرین مقاومتی در رتها استفاده شده بود که تنها 4 روز ادامه داشت، درحالیکه برنامه تمرین مقاومتی استفادهشده در مطالعه حاضر بالابردن وزنه از نردبان به مدت 6 هفته بود.
در تحقیقی جالب گزارش شده است که نوع ورزش عامل اصلی تعیینکننده برای فراوانی رونویسی RNA میوستاتین به شمار نمیرود [17]. عطارزاده حسینی و همکاران (1395) کاهش سطوح مایوستاتین سرمی در زنان را به دنبال 8 هفته تمرینات مقاومتی با شدت بالا گزارش کردند [16]. هیتل و همکاران (2010) تأثیر ششماه تمرین هوازی متوسط را بر مقادیر میوستاتین عضلانی و پلاسمایی مردان میانسال بررسی و کاهش متوسط 37 درصدی میوستاتین عضلانی و پلاسمایی را بعد از تمرین گزارش کردهاند [9]. در تحقیقی دیگر، ماتساکاس و همکاران (2005) نتایج متفاوتی را در بیان ژن میوستاتین در پاسخ به تمرین استقامتی در بافتهای مختلف گزارش کردهاند. در عضله دوقلو موشهای صحرایی تمرینکرده در بیان ژن میوستاتین کاهش 65 درصدی گزارش شد، درحالیکه در عضله پهن خارجی این کاهش متوسط و به مقدار 49 درصد بود و در عضله نعلی بین موشهای تمرینکرده و بیتمرین تغییری مشاهده نشد [10].
درحقیقت، شواهد زیادی از این ایده حمایت میکنند که تنظیم میوستاتین با توجه به نوع تارهای عضلانی ویژگی حساسیت و پاسخ دقیق تری دارند و بهشدت با ایزوفرم IIb زنجیره سنگین میوزین عضله ارتباط دارد [18] و غلظت بالای پروتئین میوستاتین در عضله تندانقباض در مقایسه با تارهای کندانقباض مشاهده شده است [19]. این گزارشها میتواند نتایج حاصل از مطالعه حاضر مبنی بر کاهش بالای 53 درصدی بیان mRNA ژن میوستاتین در عضله EDL در مقایسه با کاهش اندک 28 درصدی بیان آن در عضله سولئوس را توجیه کند.
میوستاتین علاوه بر اینکه اندازه، نوع و انقباضپذیری عضله را کنترل میکند، ترکیب ECM عضله و تاندون را احتمالاً از طریق القای بیان کلاژن نوع I تنظیم میکند [6]. بااینحال، مندیاس و همکاران (2015) نشان دادهاند که غیرفعالسازی ژنتیکی میوستاتین در رتها ضمن افزایش حجم عضلانی، تأثیر منفی بر ویژگیهای مکانیکی تاندون ندارد [20]. بر اساس نتایج حاصل از مطالعه حاضر و با در نظر گرفتن گزارش مندیاس و همکاران (2015) به نظر میرسد که سازگاریهای تاندونی ناشی از تمرینات مقاومتی بیشتر متأثر از پیامرسانی TGF-β1 بوده و میوستاتین نقش چندانی در این زمینه ایفا نمیکند. البته باید توجه داشت که جمعآوری نمونهها در مطالعه حاضر، 48 ساعت بعد از آخرین جلسه تمرینی صورت گرفته و این احتمال وجود دارد که سطح بیان میوستاتین در ساعات اولیه بعد از تمرین افزایش داشته است که این موضوع سبب سازگاریهای تاندونی میشود. عدم اندازهگیری سطوح بیان میوستاتین به صورت سریال زمانی که یکی از محدودیتهای مطالعه حاضر به شمار میرود، این تفسیر را دشوار میکند.
نتیجهگیری
بهطورکلی، تمرین مقاومتی باعث تنظیم مثبت سطوح پایه mRNA ژن TGF-β1 و تنظیم منفی سطوح پایه mRNA ژن میوستاتین در تاندون عضلات تند و کند انقباض میشود و این اثرات در عضله تندانقباض در مقایسه با عضله کندانقباض به طور قابلتوجهی بیشتر است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
همه مراحل مربوط به حیوانات با توجه به دستورالعمل اخلاقی و مجوز معاونت پژوهشی دانشگاه آزاد اسلامی واحد تهران مرکزی با شماره IR.IAU.PS.REC.1398.296 انجام شد.
حامی مالی
مقاله حاضر برگرفته از رساله دکتری نویسنده اول آقای محمدنژاد، گروه تربیت بدنی و علوم ورزشی، دانشگاه آزاد اسلامی واحد تهران مرکزی است.
مشارکت نویسندگان
تعریف موضوع و بیان مسأله: تمام نویسندگان؛ روش پژوهش: قاسم محمدنژاد؛ تحلیل دادهها: قاسم محمدنژاد؛ نگارش متن و بازبینی: تمام نویسندگان
تعارض منافع
نویسندگان مقاله هیچگونه تعارضی در منافع اعلام نکردند.
تشکر و قدردانی
از پرسنل محترم بخش فیزیولوژی و فارماکولوژی انستیتو پاستور ایران و همچنین مسئول محترم حیوانخانه دانشگاه تربیت مدرس به خاطر همکاری در اجرای این مطالعه کمال تشکر و قدردانی را داریم.
References
Schiaffino S, Reggiani C. Molecular diversity of myofibrillar proteins: Gene regulation and functional significance. Physiol Rev. 1996; 76(2):371-423. [DOI:10.1152/physrev.1996.76.2.371] [PMID]
Davis ME, Gumucio JP, Sugg KB, Bedi A, Mendias CL. MMP inhibition as a potential method to augment the healing of skeletal muscle and tendon extracellular matrix. J Appl Physiol. 2013; 115(6):884-91. [DOI:10.1152/japplphysiol.00137.2013] [PMID] [PMCID]
Kjær M, Langberg H, Heinemeier K, Bayer M, Hansen M, Holm L, et al. From mechanical loading to collagen synthesis, structural changes and function in human tendon. Scandinavian J Med Sci Sports. 2009; 19(4):500-10. [DOI:10.1111/j.1600-0838.2009.00986.x] [PMID]
Mendias CL, Gumucio JP, Bakhurin KI, Lynch EB, Brooks SV. Physiological loading of tendons induces scleraxis expression in epitenon fibroblasts. J Orthop Res. 2012; 30(4):606-12. [DOI:10.1002/jor.21550] [PMID] [PMCID]
McPherron AC, Lawler AM, Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-p superfamily member. Nature. 1997; 387(6628):83. [DOI:10.1038/387083a0] [PMID]
Mendias CL, Bakhurin KI, Faulkner JA. Tendons of myostatin-deficient mice are small, brittle, and hypocellular. Proc Natl Acad Sci. 2008; 105(1):388-93. [DOI:10.1073/pnas.0707069105] [PMID] [PMCID]
Pryce BA, Watson SS, Murchison ND, Staverosky JA, Dünker N, Schweitzer R. Recruitment and maintenance of tendon progenitors by TGFβ signaling are essential for tendon formation. Development. 2009; 136(8):1351-61. [DOI:10.1242/dev.027342] [PMID] [PMCID]
Czarkowska-Paczek B, Zendzian-Piotrowska M, Bartlomiejczyk I, Przybylski J, Gorski J. The effect of acute and prolonged endurance exercise on transforming growth factor-beta1 generation in rat skeletal and heart muscle. J Physiol Pharmacol. 2009; 60(4):157-62. [PMID]
Hittel DS, Axelson M, Sarna N, Shearer J, Huffman KM, Kraus WE. Myostatin decreases with aerobic exercise and associates with insulin resistance. Med Sci Sports Exerc. 2010; 42(11):2023-9. [DOI:10.1249/MSS.0b013e3181e0b9a8] [PMID] [PMCID]
Matsakas A, Friedel A, Hertrampf T, Diel P. Short‐term endurance training results in a muscle‐specific decrease of myostatin mRNA content in the rat. Acta physiologica scandinavica. 2005; 183(3):299-307. [DOI:10.1111/j.1365-201X.2005.01406.x] [PMID]
Gumucio JP, Sugg KB, Mendias CL. TGF-β superfamily signaling in muscle and tendon adaptation to resistance exercise. Exerc Sport Sci Rev. 2015; 43(2):93-9. [DOI:10.1249/JES.0000000000000041] [PMID] [PMCID]
Jaafari Sardoui S, Nikoei R, Sheibani V. The effect of time series of resistance training on TGF-β1 expression and muscle hypertrophy in male wistar rats. J Appl Exerc Physiol. 2015; 11(22):23-32. [DOI:10.22080/JAEP.2016.1205]
Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001; 29(9):e45. [DOI:10.1093/nar/29.9.e45] [PMID] [PMCID]
Heinemeier K, Olesen J, Haddad F, Langberg H, Kjær M, Baldwin K, et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. J Physiol. 2007; 582(3):1303-16. [DOI:10.1113/jphysiol.2007.127639] [PMID] [PMCID]
Yang G, Crawford RC, Wang JH. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 2004; 37(10):1543-50. [DOI:10.1016/j.jbiomech.2004.01.005] [PMID]
Attarzadeh Hosseini SR, Moeinnia N, Motahari Rad M. The effect of two intensities resistance training on muscle growth regulatory myokines in sedentary young women. Obes Medi. 2017; 5:25-8. [DOI:10.1016/j.obmed.2017.01.004]
Matsakas A, Bozzo C, Cacciani N, Caliaro F, Reggiani C, Mascarello F, et al. Effect of swimming on myostatin expression in white and red gastrocnemius muscle and in cardiac muscle of rats. Exp Physiol. 2006; 91(6):983-94. [DOI:10.1113/expphysiol.2006.033571] [PMID]
Carlson CJ, Booth FW, Gordon SE. Skeletal muscle myostatin mRNA expression is fiber-type specific and increases during hindlimb unloading. Am J Physiol. 1999; 277(2):R601-6. [DOI:10.1152/ajpregu.1999.277.2.R601] [PMID]
Wehling M, Cai B, Tidball JG. Modulation of myostatin expression during modified muscle use. FASEB J. 2000; 14(1):103-10. [DOI:10.1096/fasebj.14.1.103] [PMID]
Mendias CL, Lynch EB, Gumucio JP, Flood MD, Rittman DS, Van Pelt DW, et al. Changes in skeletal muscle and tendon structure and function following genetic inactivation of myostatin in rats. J Physiol. 2015; 593(8):2037-52. [DOI:10.1113/jphysiol.2014.287144] [PMID] [PMCID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |