دوره 23، شماره 1 - ( فروردین و اردیبهشت 1399 )
جلد 23 شماره 1 صفحات 33-22 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Seif Amirhoseiny E, Ganji A, Mosayebi G, Ghazavi A. Immunomodulatory Effect of Fennel in Animal Model of Polycystic Ovarian Syndrome. J Arak Uni Med Sci 2020; 23 (1) :22-33
URL: http://jams.arakmu.ac.ir/article-1-6211-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6211-fa.html
سیف امیرحسینی انسیه، گنجی علی، مسیبی قاسم، قضاوی علی. اثر ایمونومدولاتوری رازیانه در مدل حیوانی سندرم تخمدان پلی کیستیک. مجله دانشگاه علوم پزشكي اراك. 1399; 23 (1) :22-33
انسیه سیف امیرحسینی1 

 ، علی گنجی2
، علی گنجی2 

 ، قاسم مسیبی2
، قاسم مسیبی2 

 ، علی قضاوی3
، علی قضاوی3 




 ، علی گنجی2
، علی گنجی2 

 ، قاسم مسیبی2
، قاسم مسیبی2 

 ، علی قضاوی3
، علی قضاوی3 


1- گروه ایمنیشناسی و میکروبشناسی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.
2- گروه ایمنیشناسی و میکروبشناسی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات پزشکی و مولکولی، دانشگاه علوم پزشکی اراک، اراک، ایران.
3- گروه ایمنیشناسی و میکروبشناسی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات طب سنتی و مکمل، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات بیماری های عفونی، دانشگاه علوم پزشکی اراک، اراک، ایران. ،ghazaviali@yahoo.com
2- گروه ایمنیشناسی و میکروبشناسی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات پزشکی و مولکولی، دانشگاه علوم پزشکی اراک، اراک، ایران.
3- گروه ایمنیشناسی و میکروبشناسی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات طب سنتی و مکمل، دانشگاه علوم پزشکی اراک، اراک، ایران.؛ مرکز تحقیقات بیماری های عفونی، دانشگاه علوم پزشکی اراک، اراک، ایران. ،
متن کامل [PDF 6334 kb]
(2477 دریافت)
| چکیده (HTML) (5276 مشاهده)
References
Abinaya S, Siva D, Sabitha R, Achiraman Sh. An overview of hyperandrogenism in PCOS and the prospective underlying factors. Res J Life Sci Bioinform Pharm Chem Sci. 2019; 15(1):179-86. [DOI:10.26479/2019.0501.18]
Badawy A, Elnashar A. Treatment options for polycystic ovary syndrome. Int J Womens Health. 2011; 3:25-35. [DOI:10.2147/IJWH.S11304] [PMID] [PMCID]
Brazdova A, Senechal H, Peltre G, Poncet P. Immune aspects of female infertility. Int J Fertil Steril. 2016; 10(1):1-10. [DOI:10.22074/ijfs.2016.4762] [PMID] [PMCID]
Sugiyama H, Gyulai R, Toichi E, Garaczi E, Shimada S, Stevens SR, et al. Dysfunctional blood and target tissue CD4+CD25high regulatory T cells in psoriasis: Mechanism underlying unrestrained pathogenic effector T cell proliferation. J Immunol (Baltimore, Md : 1950). 2005; 174(1):164-73. [DOI:10.4049/jimmunol.174.1.164] [PMID] [PMCID]
Guerin LR, Prins JR, Robertson SA. Regulatory T-cells and immune tolerance in pregnancy: A new target for infertility treatment? Hum Reprod Update. 2009; 15(5):517-35. [DOI:10.1093/humupd/dmp004] [PMID] [PMCID]
Hatziagelaki E, Pergialiotis V, Kannenberg JM, Trakakis E, Tsiavou A, Markgraf DF, et al. Association between biomarkers of low-grade inflammation and sex hormones in women with polycystic ovary syndrome. Exp Clin Endocrinol Diabetes. 2019. [DOI:10.1055/a-0992-9114] [PMID]
Motta AB. Dehydroepiandrosterone to induce murine models for the study of polycystic ovary syndrome. J Steroid Biochem Mol Biol. 2010; 119(3-5):105-11. [DOI:10.1016/j.jsbmb.2010.02.015] [PMID]
Luchetti CG, Mikó E, Szekeres-Bartho J, Paz DA, Motta AB. Dehydroepiandrosterone and metformin modulate Progesterone-Induced Blocking Factor (PIBF), cyclooxygenase 2 (COX2) and cytokines in early pregnant mice. J Steroid Biochem Mol Biol. 2008; 111(3-5):200-7. [DOI:10.1016/j.jsbmb.2008.06.007] [PMID]
Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Consensus on infertility treatment related to polycystic ovary syndrome. Fertil Steril. 2008; 89(3):505-22. [DOI:10.1016/j.fertnstert.2007.09.041] [PMID]
Lee HS, Kang P, Kim KY, Seol GH. Foeniculum vulgare Mill. Protects against lipopolysaccharide-induced acute lung injury in mice through ERK-dependent NF-κB activation. Korean J Physiol Pharmacol. 2015; 19(2):183-9. [DOI:10.4196/kjpp.2015.19.2.183] [PMID] [PMCID]
Sadrefozalayi S, Farokhi F. Effect of the aqueous extract of Foeniculum vulgare (fennel) on the kidney in experimental PCOS female rats. Avicenna J Phytomed. 2014; 4(2):110-7. [PMID] [PMCID]
Zhang S, Chen X, Devshilt I, Yun Q, Huang C, An L, et al. Fennel main constituent, transanethole treatment against LPSinduced acute lung injury by regulation of Th17/Treg function. Mol Med Rep. 2018; 18(2):1369-76. [DOI:10.3892/mmr.2018.9149] [PMID] [PMCID]
Khazaei M, Montaseri A, Khazaei MR, Khanahmadi M. Study of Foeniculum vulgare effect on folliculogenesis in female mice. Int J Fertil Steril. 2011; 5(3):122-7. [PMID] [PMCID]
Saleem U, Amin S, Ahmad B, Azeem H, Anwar F, Mary S. Acute oral toxicity evaluation of aqueous ethanolic extract of Saccharum munja Roxb. roots in albino mice as per OECD 425 TG. Toxicol Rep. 2017; 4:580-5. [DOI:10.1016/j.toxrep.2017.10.005] [PMID] [PMCID]
Salimi-Asl M, Mozdarani H, Kadivar M. Up-regulation of miR-21 and 146a expression and increased DNA damage frequency in a mouse model of Polycystic Ovary Syndrome (PCOS). BioImpacts: BI. 2016; 6(2):85-91. [DOI:10.15171/bi.2016.12] [PMID] [PMCID]
Sadoughi SD. [Effects of crocin on ovarian follicle and serum sex hormone in letrozole-induced polycystic ovarian syndrome in rat model (Persian)]. J Ardabil Univ Med Sci. 2017; 17(2):198-210. http://jarums.arums.ac.ir/article-1-1377-en.html
Mosayebi G, Ghazavi A, Khazaei MR, Payani MA. [Effect of vitamin E on the inhibition of experimental autoimmune encephalomyelitis in C57BL/6 mouse (Persian)]. J Arak Univ Med Sci. 2006; 9(1):68-75. http://jams.arakmu.ac.ir/article-1-259-fa.html
Palizvan MR, Khademi Sh, Ghazavi A, Mosayebi Gh. [Correlation of two way active avoidance learning with Nitric Oxide and Ferric reduction/antioxidant power in rats (Persian)]. J Arak Univ Med Sci. 2006; 9(4):1-8. http://jams.arakmu.ac.ir/article-1-61-fa.html
Nasri F, Doroudchi M, Namavar Jahromi B, Gharesi-Fard B. T helper cells profile and CD4+CD25+Foxp3+Regulatory T cells in polycystic ovary syndrome. Iran J Immunol. 2018; 15(3):175-85. [DOI:10.22034/IJI.2018.39387] [PMID]
Pahlevani P, Mosavi SM, Rastgoo Haghi AR, Lahotian H, Esna Ashari F, Alizadeh Z. [Study of the effects of stachys lvandulifolia alcoholic extract on histomorphometry of endometrium in polycystic ovarian syndrome rat model (Persian)]. Avicenna J Clin Med. 2016; 23(1):40-8. http://sjh.umsha.ac.ir/article-1-855-en.html
Padua MB, Tekin Ş, Spencer TE, Hansen PJ. Actions of progesterone on uterine immunosuppression and endometrial gland development in the Uterine Gland Knockout (UGKO) ewe. Mol Reprod Dev. 2005; 71(3):347-57. [DOI:10.1002/mrd.20301] [PMID]
Yilmaz N, Inal HA, Gorkem U, Yilmaz S, Sargin A, Turkkani A. Follicular fluid total antioxidant capacity in patient with PCOS. Fertil Steril. 2013; 100(Suppl. 3):S356. [DOI:10.1016/j.fertnstert.2013.07.838]
Ahmadi A, Mostafavi M, Kalantari Hesari A. [Histological studies of the effect of licorice root hydroalcoholic extract on the structure of polycystic ovary syndrome in mice following hyperandrogenism induced by letrozole (Persian)]. Stud Med Sci. 2019; 29(12):857-68. http://umj.umsu.ac.ir/article-1-4603-en.html
Armanini D, Mattarello MJ, Fiore C, Bonanni G, Scaroni C, Sartorato P, et al. [Licorice reduces serum testosterone in healthy women (Persian)]. Steroids. 2004; 69(11-12):763-6. [DOI:10.1016/j.steroids.2004.09.005] [PMID]
Mohseni Kouchesfahani H, Nabyooni M, Adham H. [Investigating the therapeutic effect of Bee venom on polycystic ovarian syndrome in rats (Persian)]. Pejouhandeh. 2010; 15(1):1-6. http://pajoohande.sbmu.ac.ir/article-1-868-en.html
Mohseni Kouchesfahani H, Parivar K, Salmabadi Z. [Effect of hydroalcoholic grape seed extract (Vitis vinifera L.) on polycystic ovarian syndrome in female Wistar rat (Persian)]. J Cell Tissue. 2015; 6(2):153-64. https://www.sid.ir/fa/journal/ViewPaper.aspx?ID=265203
Cella M, Farina MG, Dominguez Rubio AP, Di Girolamo G, Ribeiro ML, Franchi AM. Dual effect of nitric oxide on uterine prostaglandin synthesis in a murine model of preterm labour. Br J Pharmacol. 2010; 161(4):844-55. [DOI:10.1111/j.1476-5381.2010.00911.x] [PMID] [PMCID]
Sekhon LH, Gupta S, Kim Y, Agarwal A. Female infertility and antioxidants. Curr Womens Health Rev. 2010; 6(2):84-95. [DOI:10.2174/157340410791321381]
Krishna MB, Joseph A, Subramaniam AG, Gupta A, Pillai SM, Laloraya M. Reduced Tregs in peripheral blood of PCOS patients - a consequence of aberrant Il2 signaling. J Clin Endocrinol Metab. 2015; 100(1):282-92. [DOI:10.1210/jc.2014-2401] [PMID]
متن کامل: (13221 مشاهده)
مقدمه
سندرم تخمدان پلیکیستیک یک اختلال غدد درونریز است. تخمدانهای پلیکیستیک، هیپرآندروژنیسم، سندرم متابولیک و مقاومت به انسولین از علائم این بیماری هستند [1]. بیماران مبتلا به PCOS در معرض خطر ابتلا به سرطان اندومتر، ناباروری، چاقی، فشار خون بالا و دیابت هستند . شیوع این بیماری در زنان نابارور 15 تا 20 درصد است [2]. این بیماری هتروژن بوده و علتهای مختلفی ازجمله عوامل ایمونولوژیک، عوامل هورمونی و عصبی در ایجاد آن نقش دارند [3]. سیستم ایمنی به واسطه فراخوانی سلولها و مولکولهای تنظیمی، به مقابله با متغیرهای سلولی در بدن میپردازد و میان پاسخ ایمنی مؤثر و واکنشهای کنترلنشده تعادل برقرار میکند [4]. یکی از سلولهای اصلی تنظیمی لنفوسیتهای Treg هستند که نقش مهمی در جلوگیری از التهاب دارند [5]. مطالعات حاکی از این است که در بیماران مبتلا به PCOS میزان Treg کاهش یافته و درنتیجه باعث التهاب میشود [6].
در این بیماران میزان انسولین افزایش مییابد که باعث افزایش هورمونهای جنسی میشود. افزایش هورمونهای جنسی باعث افزایش فعالیت رادیکالهای آزاد مانند نیتریک اکساید و کاهش قدرت آنتیاکسیدانی توتال از طریق کاهش فعالیت آنتیاکسیدانهایی مانند کاتالاز، سوپر اکسید دیسموتاز و گلوتاتیون پراکسیداز () شده و باعث استرس اکسیداتیو میشود [7].
امروزه داروهای متعددی مانند متفورمین وکلومیفن سیترات برای درمان این بیماری استفاده میشود. متفورمین باعث افزایش حساسیت به انسولین میشود، میزان گلوکز خون را کاهش میدهد و از بروز استرس اکسیداتیو جلوگیری میکند. عوارض جانبی این دارو اسهال، حالت تهوع، ایجاد مشکلات کبدی و کلیوی است [8]. کلومیفن سیترات نیز باعث القای تخمکگذاری در بیماران مبتلا به PCOS میشود، اما این دارو تنها در 50 درصد بیماران تخمکگذاری را بهبود میبخشد و خطر ابتلا به سرطان اندومتر را در بیماران بالا میبرد [9]. با توجه به عوارض جانبی داروهای کلاسیک، شناسایی و معرفی درمانهای جایگزین و مؤثر، اهمیت فراوانی دارد.
گیاهان دارویی به دلیل اثرات جانبی کمتر از چند دهه پیش به عنوان جایگزینی مناسب برای داروهای شیمیایی مطرح شدهاند و مصرف آنها در جهان رو به افزایش است. یکی از گیاهان دارویی که در طب سنتی به اثرات مفید آن پی بردهاند، رازیانه است. رازیانه گیاهی علفی و از خانواده Apiaceae است. نام علمی گیاه Foeniculum Vulgare است. قسمت دارویی مورد استفاده این گیاه، دانه است. دانه گیاه حاوی اسانس یا روغن فرار است و مهمترین ترکیب اسانس ترانس آنتول است. ترکیبات دیگر اسانس شامل فنچون، لیمونن، متیل کاویکول ، آلفا پینن و آلفا فلندرن است [10]. رازیانه دارای خواص فیتو استروژنی [11]، آنتیاکسیدانی [10] و ضددیابتی است . در یک مطالعه، ترانس آنتول که جزء اصلی رازیانه است، باعث کاهش Th17 و افزایش Treg در موشهای مبتلا به التهاب ناشی از LPS شد [12]. در مطالعهای دیگر، رازیانه تولید TNF-α و ترشح 9-MMP را کاهش داد که خواص ضدالتهابی رازیانه را نشان میدهد [10].
با توجه به نقش التهاب در ایمونوپاتوژنز PCOS و اثرات ضدالتهابی رازیانه، هدف از این مطالعه، بررسی اثر عصاره هیدروالکلی رازیانه بر قدرت آنتیاکسیدانی سرم، میزان نیتریک اکساید (NO) و درصد سلولهای Treg در مدل موشی سندرم تخمدان پلیکیستیک بود.
مواد و روشها
عصارهگیری
گیاه رازیانه از جهاد کشاورزی استان مرکزی تهیه شد. برای تهیه عصاره بعد از جمعآوری گیاه، آن را خشک و سپس پودر کرده و سپس عصارهگیری به روش ماسیراسیون انجام شد؛ بدینصورت که 6/19 گرم پودر از این گیاه را به 100 میلیلیتر اتانول 70 درصد (مرک، آلمان) اضافه و به مدت 24 ساعت در دمای 70 درجه سانتیگراد خیسانده شد. محتویات ظرف در طول این مدت توسط مگنت بهآرامی چرخانده شد. سپس عصاره به کمک سیستم خلاء و کاغذ واتمن 0/45 میکرومتر (واتمن، انگلیس)، فیلتر و با دستگاه Rotary evaporate (هایدولف، آلمان) غلیظ شد. عصاره در دمای 40 درجه سانتیگراد خشک و پس از توزین و محاسبه میزان بازدهی در دمای 4 درجه سانتیگراد نگهداری شد [13].
بررسی سمیت حاد
قبل از شروع پژوهش LD50 (متوسط دوز کشنده) و ED50 (متوسط دوز مؤثر) عصاره رازیانه بررسی و مشخص شد که غلظت 1000 میلیگرم بر کیلوگرم LD50 و غلظت بین 500-1 میلیگرم بر کیلوگرم ED50 است. به همین دلیل غلظت 500 میلیگرم بر کیلوگرم عصاره رازیانه به عنوان غلظت درمانی انتخاب شد [13].
طبق دستورالعمل OECD برای سنجش سمیت حاد، به طور تصادفی در هر گروه 5 سر موش سوری ماده با سن 5 الی 6 هفته قرار گرفت. موشها 5 روز قبل از آزمایش برای خو گرفتن به محیط، در قفسها نگهداری و دقیقاً قبل از شروع آزمایش، وزن شدند. گروه کنترل تنها حلال (روغن کنجد) (باریج اسانس، ایران) را به صورت تزریق داخل صفاقی (i.p) دریافت کردند. گروه درمانی با رازیانه مقدار mg/kg 500 عصاره رازیانه به مدت 14 روز دریافت کردند. حجم تزریقی برابر با mL/kg 10 بود. موشها ابتدا در 6 ساعت اول پس از تزریق و سپس روزانه برای 14 روز از نظر مرگ و میر، تغییرات وزن، الگوی رفتاری، ظاهر فیزیکی (پوست و خز)، تغییر در تنفس، آسیب، درد و علائم بیماری (لرزش، تشنج، اسهال و رخوت) پایش شدند. وزن موشها در روز هفتم و چهاردهم نیز محاسبه شد [14].
حیوانات و پروتکل آزمایش
در این مطالعه از 18 سر موش BALB/C ماده نابالغ 21 روزه با وزن حدود 14 گرم استفاده شد. حیوانات از انستیتو پاستور ایران تهیه و در دمای تقریبی 24-22 درجه سانتیگراد، دوره روشنایی تاریکی 12 ساعته و شرایط آب و غذایی یکسان نگهداری شدند. موشها به 3 گروه 6 تایی شامل گروه کنترل منفی، گروه کنترل مثبت و گروه درمانی با رازیانه تقسیم شدند. گروه کنترل منفی به مدت 21 روز 1/0 میلیلیتر روغن کنجد (باریج اسانس، ایران) به صورت زیرجلدی (s.c) دریافت کردند. گروههای کنترل مثبت و درمانی با رازیانه به مدت 21 روز 60 میلیگرم بر کیلوگرم (DHEA (Dehydroepiandrosterone (سیگما، آمریکا) در 0/1 میلیلیتر روغن کنجد به صورت s.c برای القا PCOS دریافت کردند [15].
بعد از 21 روز گروه درمانی با رازیانه به مدت 21 روز 5/0 میلیلیتر عصاره رازیانه را به صورت i.p با غلظت 500 میلیگرم بر کیلوگرم دریافت کردند. وزن موشها، هر 3 تا 4 روز یک بار با ترازو (متلر تولدو، سوئیس) و سیکل جنسی سه دوره در طول 42 روز به وسیله اسمیر واژینال تعیین شد. بعد از 42 روز حیوانات با کتامین (روتکس مدیکا، آلمان) به غلظت mg/kg 20 و زایلازین (آلفاسان، هلند) با غلظت mg/kg 100 بیهوش و سپس نخاعی شدند. خونگیری به وسیله سرنگهای هپارینه از قلب انجام شد. خونها بعد از یک ساعت به وسیله سانتریفیوژ (بکمن کالتر، آمریکا) سانتریفیوژ شدند و سرم نمونهها بعد از جداسازی در 70- درجه سانتیگراد برای آزمایش NO و FRAP نگهداری شدند. تخمدان چپ جدا و در فرمالدئید 10 درصد (سپیدان متین آسیا، ایران) به مدت 72 ساعت برای بررسی هیستومورفولوژی تخمدان فیکس شد. اسپلنوسیتها نیز از طریق پرفیوژ از طحال جدا شد و پس از لیز گلبولهای قرمز برای شمارش سلولهای Treg به کار رفت.
بررسی سیکل استروس (سیکل جنسی)
در سه دوره 7 روزه (دوره اول، یک هفته پس از دریافت P، دوره دوم آخرین هفته دریافت P و دوره سوم، هفته آخر درمان با عصاره رازیانه) از موشها اسمیر واژینال تهیه و با تریپان بلو (مرک، آلمان)، رنگآمیزی شد و چهار فاز پرو استروس، استروس، دی استروس و مت استروس در زیر میکروسکوپ بررسی شد.
هیستومورفولوژی تخمدان
ابتدا تخمدان چپ از حفره شکمی موشها خارج و با محلول سرم فیزیولوژی شستوشو داده شد و سپس در فرمالدئید 10 درصد (سپیدان متین آسیا، ایران) قرار گرفت. پس از تثبیت نمونههای بافتی، مراحل آبگیری، شفافسازی و قالبگیری طی شد و مقاطع 7 میکرونی تهیه و به روش هماتوکسیلین ائوزین رنگآمیزی شد.
شمارش تعداد جسم زرد و دستجات فولیکولهای سالم با استفاده از میکروسکوپ نوری و با بزرگنمایی × 04 انجام شد و تعداد فولیکولهای پری آنترال (دارای چندین لایه سلول گرانولوزا)، آنترال (دارای حفره) و کیستیک شمارش شد [16].
سنجش نیتریک اکساید
این کار بر اساس روش گریس انجام پذیرفت. مواد شیمیایی استفادهشده در این آزمایش از شرکت مرک آلمان تهیه شدند. بهطورخلاصه، سرم نمونهها در حجم 100 لاندا به میکروپلیت 96 خانه اضافه شد. 100 لاندا سولفانیل آمید 1 درصد به هر چاهک اضافه و به مدت 10 دقیقه انکوبه شد؛ سپس 100 لاندا NED 1/0 درصد به هر چاهک اضافه و به مدت 10 دقیقه انکوبه شد. جذب نوری نمونهها در طول موج 540 نانومتر با دستگاه خوانشگر الایزا خوانده و با استفاده از منحنی استاندارد غلظت نمونهها محاسبه شد [17] .
آزمایش FRAP
مواد شیمیایی استفادهشده در این مطالعه از شرکت مرک آلمان تهیه شدند. بهطورخلاصه، معرف FRAP با مخلوط کردن10 لاندا بافر استات 300 میکرو مولار، 1 لاندا TPTZ 10 میکرو مولار و 1 لاندا محلول کلرید فریک 20 میکرو مولار آماده شد. 200 لاندا معرف FRAP را به 10 لاندا از نمونهها اضافه کرده و 10 دقیقه در دمای 37 درجه سانتی گراد انکوبه شد؛ سپس جذب نوری نمونهها در طول موج 593 نانومتر با دستگاه خوانشگر الایزا خوانده شد و با استفاده از منحنی استاندارد غلظت نمونهها محاسبه گردید [18].
شمارش Treg
برای شمارش Treg از آنتیبادی مونوکلونال علیه CD4(PE)، CD25(PerCP)، FOXP3(FITC) (BD، آمریکا) استفاده شد. اسپلنوسیتهای رنگآمیزیشده توسط دستگاه فلوسایتومتری (™BD FACSCalibur، آمریکا) ارزیابی شد. برای قابل قبول بودن قدرت آماری مطالعه در خصوص سلولهای Treg که جمعیت کوچکی هستند، از هر گیت تعداد 20 هزار سلول شمارش شد. دادهها توسط نرم افزار FlowJo آنالیز شد [19].
آنالیز آماری
اطلاعات بهدستآمده توسط نرم افزار آماری SPSS نسخه 20 تحلیل شد. برای مقایسه میانگین بین گروههای مورد آزمایش از آزمون آنالیز واریانس یکطرفه و آزمون تعقیبی شفه (Scheffe’s post-hoc test) استفاده شد. نتایج به صورت (Mean±SD) گزارش شد. 0/05 >P، معنیدار در نظر گرفته شد.
یافتهها
بازدهی عصارهگیری
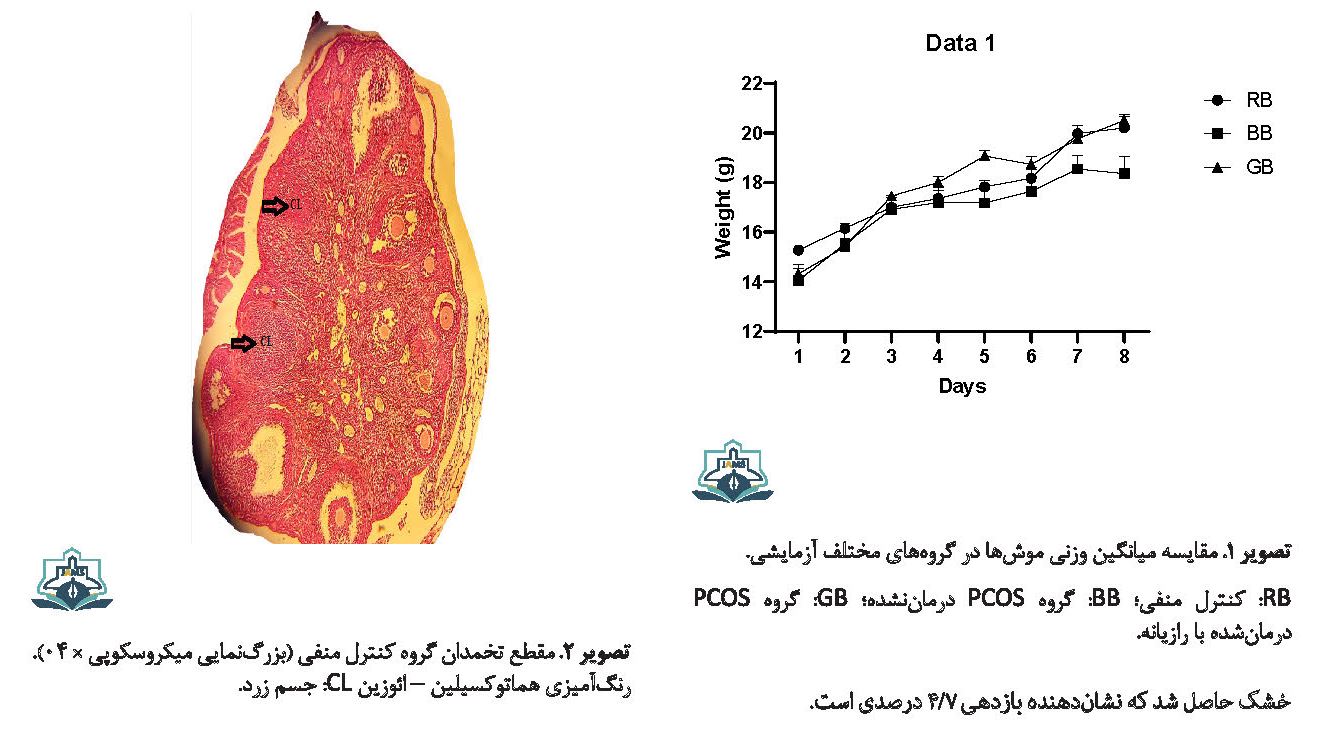
از 19/6 گرم پودر گیاه رازیانه درنهایت مقدار 0/9 گرم عصاره خشک حاصل شد که نشاندهنده بازدهی 4/7 درصدی است.
نتایج سمیت حاد
تغییری در ظاهر فیزیکی موشها (پوست و خز) و تنفس مشاهده نشد. علائم بیماری (لرزش، تشنج، اسهال و رخوت) در موشها دیده نشد. میانگین وزنی در روزهای اول، هفتم و چهاردهم در گروه درمانی با رازیانه افزایش یافت، ولی این افزایش معنیدار نبود.
بررسی تغییرات وزن
میانگین وزنی در گروه PCOS نسبت به گروه کنترل کاهش یافت، ولی این کاهش معنیدار نبود (0/151=P). میانگین وزنی در گروه درمانی با عصاره رازیانه نسبت به گروه PCOS تغییر معنیداری نداشت (0/955=P) (تصویر شماره 1).
سندرم تخمدان پلیکیستیک یک اختلال غدد درونریز است. تخمدانهای پلیکیستیک، هیپرآندروژنیسم، سندرم متابولیک و مقاومت به انسولین از علائم این بیماری هستند [1]. بیماران مبتلا به PCOS در معرض خطر ابتلا به سرطان اندومتر، ناباروری، چاقی، فشار خون بالا و دیابت هستند . شیوع این بیماری در زنان نابارور 15 تا 20 درصد است [2]. این بیماری هتروژن بوده و علتهای مختلفی ازجمله عوامل ایمونولوژیک، عوامل هورمونی و عصبی در ایجاد آن نقش دارند [3]. سیستم ایمنی به واسطه فراخوانی سلولها و مولکولهای تنظیمی، به مقابله با متغیرهای سلولی در بدن میپردازد و میان پاسخ ایمنی مؤثر و واکنشهای کنترلنشده تعادل برقرار میکند [4]. یکی از سلولهای اصلی تنظیمی لنفوسیتهای Treg هستند که نقش مهمی در جلوگیری از التهاب دارند [5]. مطالعات حاکی از این است که در بیماران مبتلا به PCOS میزان Treg کاهش یافته و درنتیجه باعث التهاب میشود [6].
در این بیماران میزان انسولین افزایش مییابد که باعث افزایش هورمونهای جنسی میشود. افزایش هورمونهای جنسی باعث افزایش فعالیت رادیکالهای آزاد مانند نیتریک اکساید و کاهش قدرت آنتیاکسیدانی توتال از طریق کاهش فعالیت آنتیاکسیدانهایی مانند کاتالاز، سوپر اکسید دیسموتاز و گلوتاتیون پراکسیداز () شده و باعث استرس اکسیداتیو میشود [7].
امروزه داروهای متعددی مانند متفورمین وکلومیفن سیترات برای درمان این بیماری استفاده میشود. متفورمین باعث افزایش حساسیت به انسولین میشود، میزان گلوکز خون را کاهش میدهد و از بروز استرس اکسیداتیو جلوگیری میکند. عوارض جانبی این دارو اسهال، حالت تهوع، ایجاد مشکلات کبدی و کلیوی است [8]. کلومیفن سیترات نیز باعث القای تخمکگذاری در بیماران مبتلا به PCOS میشود، اما این دارو تنها در 50 درصد بیماران تخمکگذاری را بهبود میبخشد و خطر ابتلا به سرطان اندومتر را در بیماران بالا میبرد [9]. با توجه به عوارض جانبی داروهای کلاسیک، شناسایی و معرفی درمانهای جایگزین و مؤثر، اهمیت فراوانی دارد.
گیاهان دارویی به دلیل اثرات جانبی کمتر از چند دهه پیش به عنوان جایگزینی مناسب برای داروهای شیمیایی مطرح شدهاند و مصرف آنها در جهان رو به افزایش است. یکی از گیاهان دارویی که در طب سنتی به اثرات مفید آن پی بردهاند، رازیانه است. رازیانه گیاهی علفی و از خانواده Apiaceae است. نام علمی گیاه Foeniculum Vulgare است. قسمت دارویی مورد استفاده این گیاه، دانه است. دانه گیاه حاوی اسانس یا روغن فرار است و مهمترین ترکیب اسانس ترانس آنتول است. ترکیبات دیگر اسانس شامل فنچون، لیمونن، متیل کاویکول ، آلفا پینن و آلفا فلندرن است [10]. رازیانه دارای خواص فیتو استروژنی [11]، آنتیاکسیدانی [10] و ضددیابتی است . در یک مطالعه، ترانس آنتول که جزء اصلی رازیانه است، باعث کاهش Th17 و افزایش Treg در موشهای مبتلا به التهاب ناشی از LPS شد [12]. در مطالعهای دیگر، رازیانه تولید TNF-α و ترشح 9-MMP را کاهش داد که خواص ضدالتهابی رازیانه را نشان میدهد [10].
با توجه به نقش التهاب در ایمونوپاتوژنز PCOS و اثرات ضدالتهابی رازیانه، هدف از این مطالعه، بررسی اثر عصاره هیدروالکلی رازیانه بر قدرت آنتیاکسیدانی سرم، میزان نیتریک اکساید (NO) و درصد سلولهای Treg در مدل موشی سندرم تخمدان پلیکیستیک بود.
مواد و روشها
عصارهگیری
گیاه رازیانه از جهاد کشاورزی استان مرکزی تهیه شد. برای تهیه عصاره بعد از جمعآوری گیاه، آن را خشک و سپس پودر کرده و سپس عصارهگیری به روش ماسیراسیون انجام شد؛ بدینصورت که 6/19 گرم پودر از این گیاه را به 100 میلیلیتر اتانول 70 درصد (مرک، آلمان) اضافه و به مدت 24 ساعت در دمای 70 درجه سانتیگراد خیسانده شد. محتویات ظرف در طول این مدت توسط مگنت بهآرامی چرخانده شد. سپس عصاره به کمک سیستم خلاء و کاغذ واتمن 0/45 میکرومتر (واتمن، انگلیس)، فیلتر و با دستگاه Rotary evaporate (هایدولف، آلمان) غلیظ شد. عصاره در دمای 40 درجه سانتیگراد خشک و پس از توزین و محاسبه میزان بازدهی در دمای 4 درجه سانتیگراد نگهداری شد [13].
بررسی سمیت حاد
قبل از شروع پژوهش LD50 (متوسط دوز کشنده) و ED50 (متوسط دوز مؤثر) عصاره رازیانه بررسی و مشخص شد که غلظت 1000 میلیگرم بر کیلوگرم LD50 و غلظت بین 500-1 میلیگرم بر کیلوگرم ED50 است. به همین دلیل غلظت 500 میلیگرم بر کیلوگرم عصاره رازیانه به عنوان غلظت درمانی انتخاب شد [13].
طبق دستورالعمل OECD برای سنجش سمیت حاد، به طور تصادفی در هر گروه 5 سر موش سوری ماده با سن 5 الی 6 هفته قرار گرفت. موشها 5 روز قبل از آزمایش برای خو گرفتن به محیط، در قفسها نگهداری و دقیقاً قبل از شروع آزمایش، وزن شدند. گروه کنترل تنها حلال (روغن کنجد) (باریج اسانس، ایران) را به صورت تزریق داخل صفاقی (i.p) دریافت کردند. گروه درمانی با رازیانه مقدار mg/kg 500 عصاره رازیانه به مدت 14 روز دریافت کردند. حجم تزریقی برابر با mL/kg 10 بود. موشها ابتدا در 6 ساعت اول پس از تزریق و سپس روزانه برای 14 روز از نظر مرگ و میر، تغییرات وزن، الگوی رفتاری، ظاهر فیزیکی (پوست و خز)، تغییر در تنفس، آسیب، درد و علائم بیماری (لرزش، تشنج، اسهال و رخوت) پایش شدند. وزن موشها در روز هفتم و چهاردهم نیز محاسبه شد [14].
حیوانات و پروتکل آزمایش
در این مطالعه از 18 سر موش BALB/C ماده نابالغ 21 روزه با وزن حدود 14 گرم استفاده شد. حیوانات از انستیتو پاستور ایران تهیه و در دمای تقریبی 24-22 درجه سانتیگراد، دوره روشنایی تاریکی 12 ساعته و شرایط آب و غذایی یکسان نگهداری شدند. موشها به 3 گروه 6 تایی شامل گروه کنترل منفی، گروه کنترل مثبت و گروه درمانی با رازیانه تقسیم شدند. گروه کنترل منفی به مدت 21 روز 1/0 میلیلیتر روغن کنجد (باریج اسانس، ایران) به صورت زیرجلدی (s.c) دریافت کردند. گروههای کنترل مثبت و درمانی با رازیانه به مدت 21 روز 60 میلیگرم بر کیلوگرم (DHEA (Dehydroepiandrosterone (سیگما، آمریکا) در 0/1 میلیلیتر روغن کنجد به صورت s.c برای القا PCOS دریافت کردند [15].
بعد از 21 روز گروه درمانی با رازیانه به مدت 21 روز 5/0 میلیلیتر عصاره رازیانه را به صورت i.p با غلظت 500 میلیگرم بر کیلوگرم دریافت کردند. وزن موشها، هر 3 تا 4 روز یک بار با ترازو (متلر تولدو، سوئیس) و سیکل جنسی سه دوره در طول 42 روز به وسیله اسمیر واژینال تعیین شد. بعد از 42 روز حیوانات با کتامین (روتکس مدیکا، آلمان) به غلظت mg/kg 20 و زایلازین (آلفاسان، هلند) با غلظت mg/kg 100 بیهوش و سپس نخاعی شدند. خونگیری به وسیله سرنگهای هپارینه از قلب انجام شد. خونها بعد از یک ساعت به وسیله سانتریفیوژ (بکمن کالتر، آمریکا) سانتریفیوژ شدند و سرم نمونهها بعد از جداسازی در 70- درجه سانتیگراد برای آزمایش NO و FRAP نگهداری شدند. تخمدان چپ جدا و در فرمالدئید 10 درصد (سپیدان متین آسیا، ایران) به مدت 72 ساعت برای بررسی هیستومورفولوژی تخمدان فیکس شد. اسپلنوسیتها نیز از طریق پرفیوژ از طحال جدا شد و پس از لیز گلبولهای قرمز برای شمارش سلولهای Treg به کار رفت.
بررسی سیکل استروس (سیکل جنسی)
در سه دوره 7 روزه (دوره اول، یک هفته پس از دریافت P، دوره دوم آخرین هفته دریافت P و دوره سوم، هفته آخر درمان با عصاره رازیانه) از موشها اسمیر واژینال تهیه و با تریپان بلو (مرک، آلمان)، رنگآمیزی شد و چهار فاز پرو استروس، استروس، دی استروس و مت استروس در زیر میکروسکوپ بررسی شد.
هیستومورفولوژی تخمدان
ابتدا تخمدان چپ از حفره شکمی موشها خارج و با محلول سرم فیزیولوژی شستوشو داده شد و سپس در فرمالدئید 10 درصد (سپیدان متین آسیا، ایران) قرار گرفت. پس از تثبیت نمونههای بافتی، مراحل آبگیری، شفافسازی و قالبگیری طی شد و مقاطع 7 میکرونی تهیه و به روش هماتوکسیلین ائوزین رنگآمیزی شد.
شمارش تعداد جسم زرد و دستجات فولیکولهای سالم با استفاده از میکروسکوپ نوری و با بزرگنمایی × 04 انجام شد و تعداد فولیکولهای پری آنترال (دارای چندین لایه سلول گرانولوزا)، آنترال (دارای حفره) و کیستیک شمارش شد [16].
سنجش نیتریک اکساید
این کار بر اساس روش گریس انجام پذیرفت. مواد شیمیایی استفادهشده در این آزمایش از شرکت مرک آلمان تهیه شدند. بهطورخلاصه، سرم نمونهها در حجم 100 لاندا به میکروپلیت 96 خانه اضافه شد. 100 لاندا سولفانیل آمید 1 درصد به هر چاهک اضافه و به مدت 10 دقیقه انکوبه شد؛ سپس 100 لاندا NED 1/0 درصد به هر چاهک اضافه و به مدت 10 دقیقه انکوبه شد. جذب نوری نمونهها در طول موج 540 نانومتر با دستگاه خوانشگر الایزا خوانده و با استفاده از منحنی استاندارد غلظت نمونهها محاسبه شد [17] .
آزمایش FRAP
مواد شیمیایی استفادهشده در این مطالعه از شرکت مرک آلمان تهیه شدند. بهطورخلاصه، معرف FRAP با مخلوط کردن10 لاندا بافر استات 300 میکرو مولار، 1 لاندا TPTZ 10 میکرو مولار و 1 لاندا محلول کلرید فریک 20 میکرو مولار آماده شد. 200 لاندا معرف FRAP را به 10 لاندا از نمونهها اضافه کرده و 10 دقیقه در دمای 37 درجه سانتی گراد انکوبه شد؛ سپس جذب نوری نمونهها در طول موج 593 نانومتر با دستگاه خوانشگر الایزا خوانده شد و با استفاده از منحنی استاندارد غلظت نمونهها محاسبه گردید [18].
شمارش Treg
برای شمارش Treg از آنتیبادی مونوکلونال علیه CD4(PE)، CD25(PerCP)، FOXP3(FITC) (BD، آمریکا) استفاده شد. اسپلنوسیتهای رنگآمیزیشده توسط دستگاه فلوسایتومتری (™BD FACSCalibur، آمریکا) ارزیابی شد. برای قابل قبول بودن قدرت آماری مطالعه در خصوص سلولهای Treg که جمعیت کوچکی هستند، از هر گیت تعداد 20 هزار سلول شمارش شد. دادهها توسط نرم افزار FlowJo آنالیز شد [19].
آنالیز آماری
اطلاعات بهدستآمده توسط نرم افزار آماری SPSS نسخه 20 تحلیل شد. برای مقایسه میانگین بین گروههای مورد آزمایش از آزمون آنالیز واریانس یکطرفه و آزمون تعقیبی شفه (Scheffe’s post-hoc test) استفاده شد. نتایج به صورت (Mean±SD) گزارش شد. 0/05 >P، معنیدار در نظر گرفته شد.
یافتهها
بازدهی عصارهگیری
از 19/6 گرم پودر گیاه رازیانه درنهایت مقدار 0/9 گرم عصاره خشک حاصل شد که نشاندهنده بازدهی 4/7 درصدی است.
نتایج سمیت حاد
تغییری در ظاهر فیزیکی موشها (پوست و خز) و تنفس مشاهده نشد. علائم بیماری (لرزش، تشنج، اسهال و رخوت) در موشها دیده نشد. میانگین وزنی در روزهای اول، هفتم و چهاردهم در گروه درمانی با رازیانه افزایش یافت، ولی این افزایش معنیدار نبود.
بررسی تغییرات وزن
میانگین وزنی در گروه PCOS نسبت به گروه کنترل کاهش یافت، ولی این کاهش معنیدار نبود (0/151=P). میانگین وزنی در گروه درمانی با عصاره رازیانه نسبت به گروه PCOS تغییر معنیداری نداشت (0/955=P) (تصویر شماره 1).
بررسی فازهای جنسی
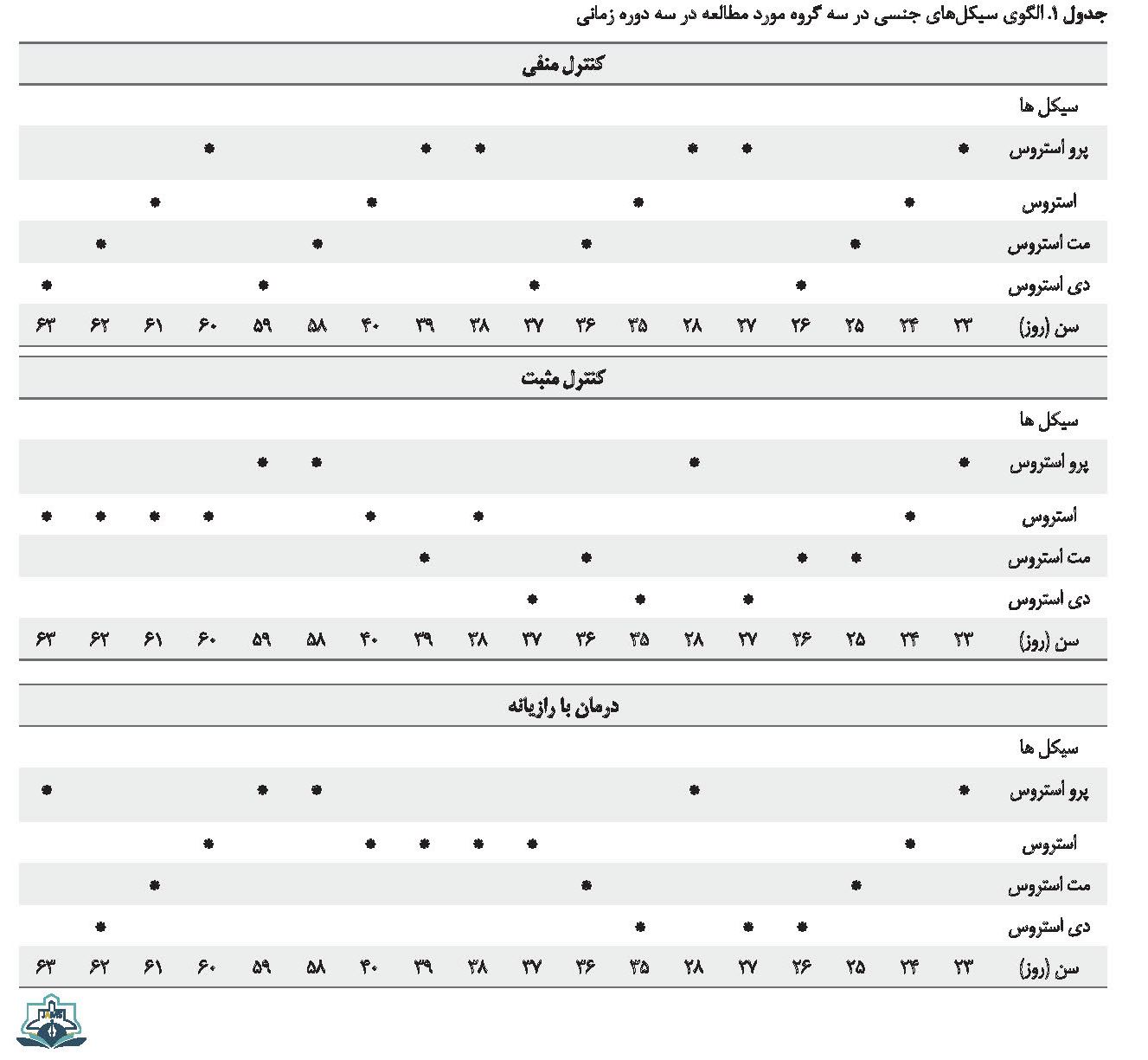
در شروع تزریق P به موشها، سیکلهای جنسی منظم بود، ولی بهتدریج نامنظم شد که نامنظم شدن سیکلها یکی از علائم وجود فولیکولهای کیستیک در تخمدان است. بعد از درمان با عصاره رازیانه سیکلها دوباره منظم شد (جدول شماره 1).
در شروع تزریق P به موشها، سیکلهای جنسی منظم بود، ولی بهتدریج نامنظم شد که نامنظم شدن سیکلها یکی از علائم وجود فولیکولهای کیستیک در تخمدان است. بعد از درمان با عصاره رازیانه سیکلها دوباره منظم شد (جدول شماره 1).
سیکلها در بین روزهای 23 تا 28 که مربوط به اوایل القا توسط P است، منظماند. روز 35 تا 40 مربوط به اواخر القا توسط P است که نشان میدهد فازها به هم ریختهاند. روز 58 تا 63 مربوط به اواخر درمان با عصاره رازیانه است که نشان میدهد فازها دوباره منظم شدهاند.
مقایسه تعداد فولیکولهای سالم در گروههای مختلف آزمایشی:
فولیکولهای پری آنترال (Preantral) و آنترال (Antral) جزو فولیکولهای سالم محسوب میشوند. در فولیکولهای موشهای گروه کنترل منفی، سلولهای گرانولوزا کاملاً مرتب در کنار یکدیگر قرار داشتند. در این گروه، درون فولیکولها هیچ ماکروفاژی دیده نشد و اووسیت حالت کروی داشت (تصویر شماره 2).
مقایسه تعداد فولیکولهای سالم در گروههای مختلف آزمایشی:
فولیکولهای پری آنترال (Preantral) و آنترال (Antral) جزو فولیکولهای سالم محسوب میشوند. در فولیکولهای موشهای گروه کنترل منفی، سلولهای گرانولوزا کاملاً مرتب در کنار یکدیگر قرار داشتند. در این گروه، درون فولیکولها هیچ ماکروفاژی دیده نشد و اووسیت حالت کروی داشت (تصویر شماره 2).
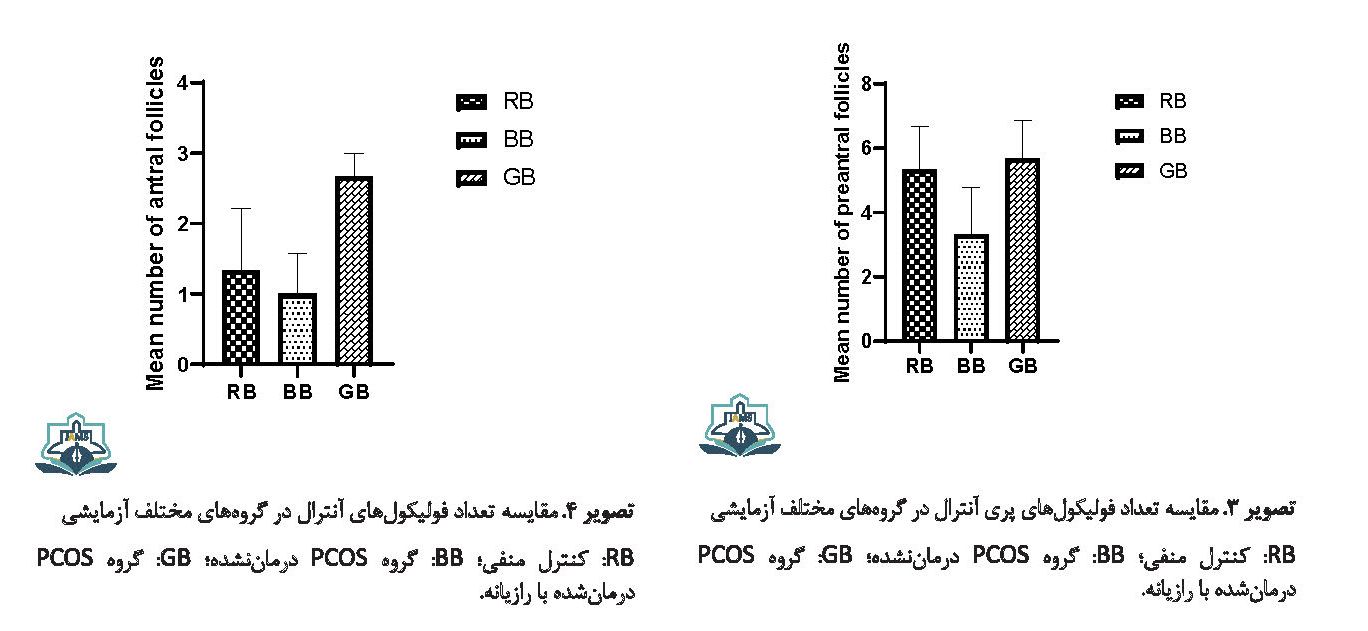
تعداد فولیکولهای پری آنترال در گروه PCOS در مقایسه با گروه کنترل کاهش یافت، ولی این کاهش معنیدار نشد (0/434=P). تجویز رازیانه موجب افزایش تعداد فولیکولهای پری آنترال شد که این افزایش معنیدار نبود (0/304=P) (تصویر شماره 3).
تعداد فولیکولهای آنترال در گروه PCOS در مقایسه با گروه کنترل تفاوتی نداشت (952/0=P). تجویز رازیانه موجب افزایش در تعداد فولیکولهای آنترال شد، ولی این افزایش معنیدار نبود (0/070=P) (تصویر شماره 4).
مقایسه تعداد فولیکولهای کیستیک در گروههای مختلف آزمایشی
در فولیکول کیستیک درون حفره آنتروم تعداد زیادی ماکروفاژ دیده شد. اووسیت به حالت کشیده وکنارههای اووسیت به شکل مضرس بودند (تصویر شماره 5). تعداد فولیکولهای کیستیک در گروه PCOS در مقایسه با گروه کنترل به طور معنیداری افزایش یافت (0/0001=P). تجویز رازیانه موجب کاهش معنیدار تعداد فولیکولهای کیستیک شد (0/005=P) (تصویر شماره 6).
مقایسه تعداد جسم زرد در گروههای مختلف آزمایشی
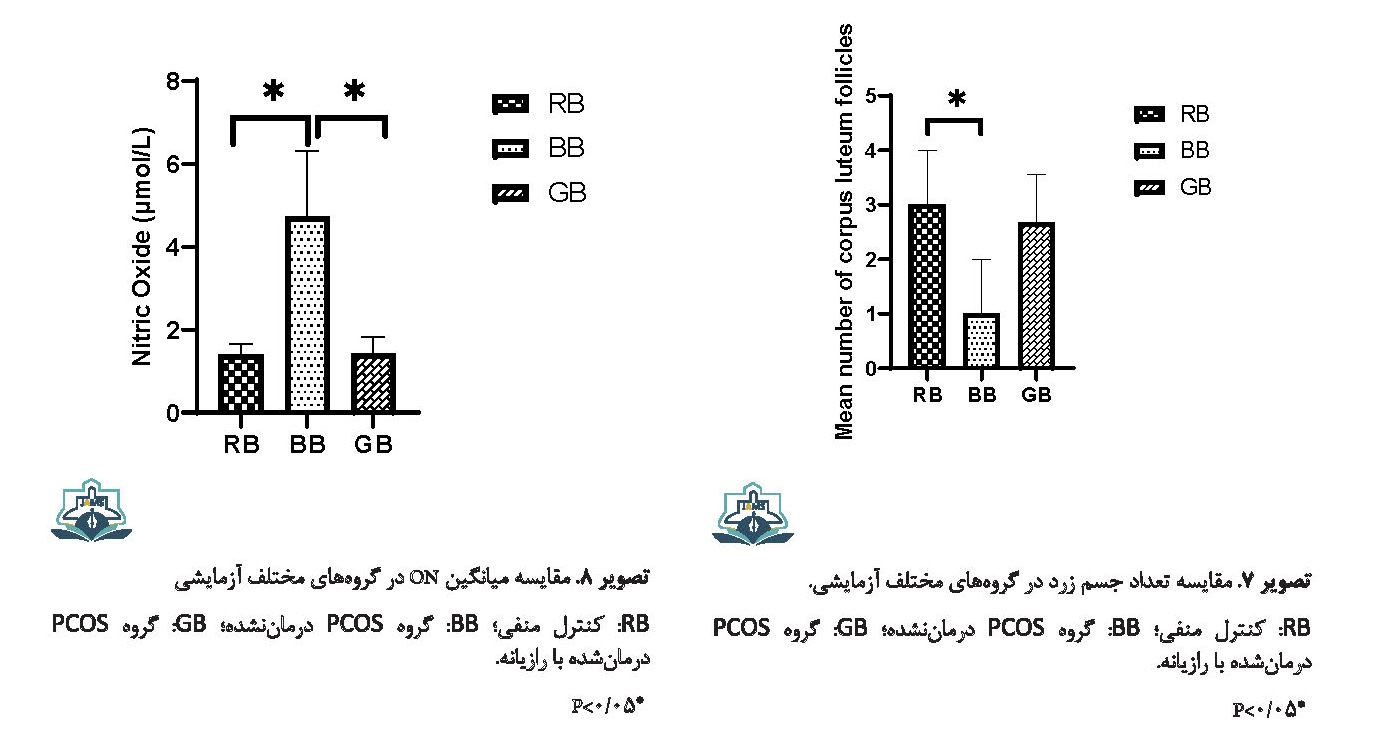
تعداد جسم زرد در گروه PCOS در مقایسه با گروه کنترل به طور معنیداری کاهش یافت (0/033=P). تجویز رازیانه موجب افزایش تعداد جسم زرد شد، ولی این افزایش معنیدار نبود (0/09=P) (تصویر شماره 7).
تعداد فولیکولهای آنترال در گروه PCOS در مقایسه با گروه کنترل تفاوتی نداشت (952/0=P). تجویز رازیانه موجب افزایش در تعداد فولیکولهای آنترال شد، ولی این افزایش معنیدار نبود (0/070=P) (تصویر شماره 4).
مقایسه تعداد فولیکولهای کیستیک در گروههای مختلف آزمایشی
در فولیکول کیستیک درون حفره آنتروم تعداد زیادی ماکروفاژ دیده شد. اووسیت به حالت کشیده وکنارههای اووسیت به شکل مضرس بودند (تصویر شماره 5). تعداد فولیکولهای کیستیک در گروه PCOS در مقایسه با گروه کنترل به طور معنیداری افزایش یافت (0/0001=P). تجویز رازیانه موجب کاهش معنیدار تعداد فولیکولهای کیستیک شد (0/005=P) (تصویر شماره 6).
مقایسه تعداد جسم زرد در گروههای مختلف آزمایشی
تعداد جسم زرد در گروه PCOS در مقایسه با گروه کنترل به طور معنیداری کاهش یافت (0/033=P). تجویز رازیانه موجب افزایش تعداد جسم زرد شد، ولی این افزایش معنیدار نبود (0/09=P) (تصویر شماره 7).
اثر عصاره هیدروالکلی رازیانه بر غلظت NO
غلظت NO در گروه PCOS نسبت به گروه کنترل افزایش معنیداری داشت (0/001=P). در گروه درمانی با رازیانه غلظت NO نسبت به گروه PCOS کاهش معنیداری داشت (0/002=P) (تصویر شماره 8).
غلظت NO در گروه PCOS نسبت به گروه کنترل افزایش معنیداری داشت (0/001=P). در گروه درمانی با رازیانه غلظت NO نسبت به گروه PCOS کاهش معنیداری داشت (0/002=P) (تصویر شماره 8).
اثر عصاره رازیانه بر میزان FRAP
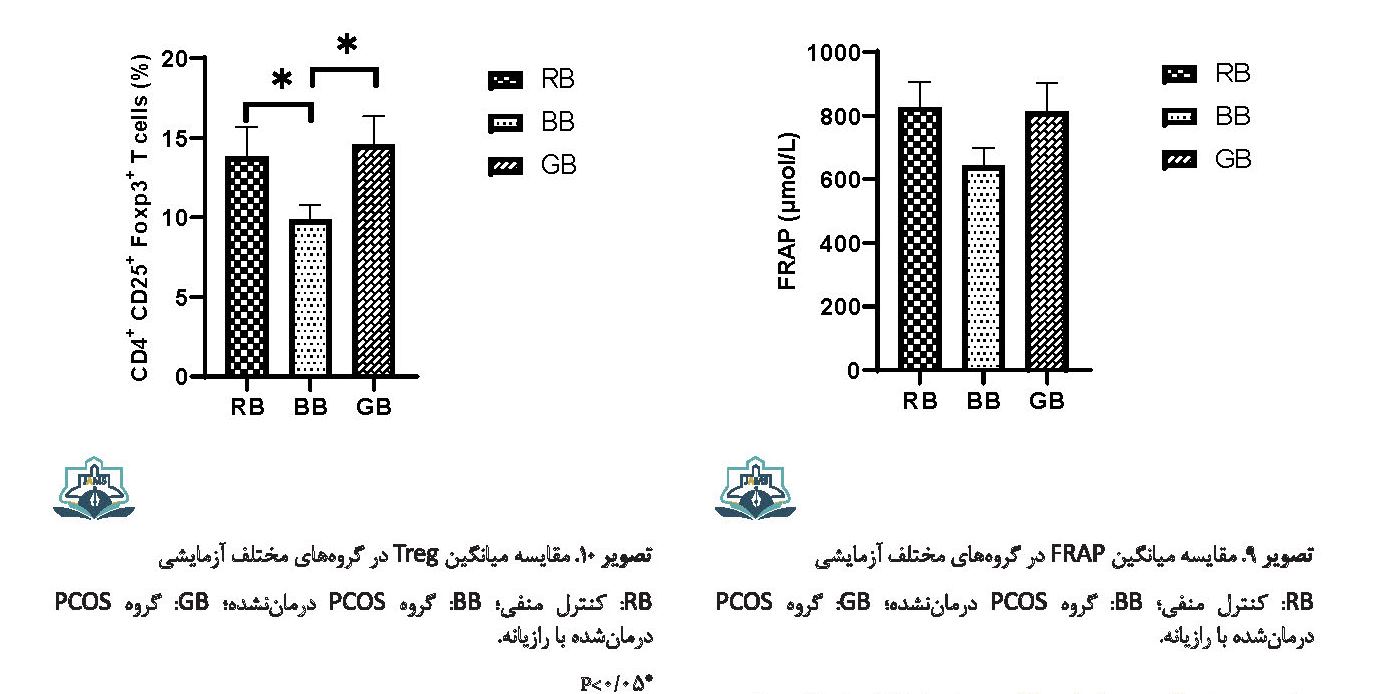
میزان FRAP در گروه PCOS نسبت به گروه کنترل کاهش یافت، ولی این کاهش معنیدار نبود (0/68=P). میزان FRAP در گروه درمانی با رازیانه نسبت به گروه PCOS افزایش یافت، ولی این افزایش معنیدار نبود (0/57=P) (تصویر شماره 9).
میزان FRAP در گروه PCOS نسبت به گروه کنترل کاهش یافت، ولی این کاهش معنیدار نبود (0/68=P). میزان FRAP در گروه درمانی با رازیانه نسبت به گروه PCOS افزایش یافت، ولی این افزایش معنیدار نبود (0/57=P) (تصویر شماره 9).
مقایسه میانگین Treg در گروههای مختلف آزمایشی:
تعداد سلولهای Treg در موشهای مبتلا به PCOS نسبت به گروه کنترل کاهش معنیداری داشت (0/008=P). درمان با رازیانه تعداد سلولهای Treg را به طور معنیداری افزایش داد (0/003=P) (تصویر شماره 10).
بحث
سندرم تخمدان پلیکیستیک، شایعترین اختلال اندوکرین زنان در سنین باروری و شایعترین علت ناباروری ناشی از عدم تخمکگذاری است. مطالعات متعددی برای کاهش و جلوگیری از عوارض این بیماری صورت گرفته است [20]. در این مطالعه، اثر عصاره هیدروالکلی رازیانه بر تعدادی از فاکتورهای التهابی در مدل موشی سندرم تخمدان پلیکیستیک بررسی شد.
عدم مرگومیر و عدم تغییرات فیزیکی و فیزیولوژیک در تست سمیت حاد نشاندهنده بیخطر بودن غلظت 500 میلیگرم بر کیلوگرم عصاره رازیانه بود و ازاینرو این غلظت به عنوان غلظت درمانی به کار رفت.
القای PCOS در موشها باعث نامنظم شدن سیکلهای جنسی، افزایش معنیدار تعداد فولیکولهای کیستیک و کاهش معنیدار تعداد جسم زرد شد. این نتایج حاکی از القای موفق PCOS در مدل حیوانی مطالعه حاضر است. سیکلهای جنسی بعد از درمان با عصاره رازیانه دوباره منظم شد که نشاندهنده اثربخشی عصاره هیدروالکلی رازیانه در کاهش علائم PCOS است (تصویر شماره 11).
رازیانه گیاهی با خواص ضدالتهابی، آنتیاکسیدانی و فیتواستروژنی است [10, 11]. تجویز عصاره رازیانه به طور معنیداری، تعداد فولیکولهای کیستیک را کاهش داد.
یکی از مشخصات مهم این بیماری کاهش در میزان تخمکگذاری است و این امر باعث میشود که تعداد جسم زرد در تخمدانهای پلیکیستیک به میزان قابلتوجهی کاهش یابد. میزان پروژسترون نیز در PCOS کاهش چشمگیری دارد که علت این امر را میتوان به کاهش یا عدم جسم زرد تخمدان ربط داد [21]. مطالعات حاکی از آن است که ترکیبات فلاونوئیدی در گیاهان با فعالیت آنتیاکسیدانی میتوانند به کاهش استرس اکسیداتیو در بافت تخمدان و کاهش تعداد فولیکولهای کیستیک در این بافت منجر شوند [22].
آنتیاکسیدانهای گیاهی، عوارض ناشی از هیپرآندروژنیسم به دنبال القای PCOS در موشها را نیز کاهش میدهند [23]. خاصیت آنتیآندروژنی گیاهان نیز با القای فیدبک منفی بر (Lteinizing hormone) LH، میزان ترشح آندروژنها را کاهش میدهند. کاهش آندروژنها منجر به سنتز کمتر LH میشود و از تأثیر غالب LH بر FSH (Follicle-stimulating hormone) میکاهد که خود میتواند دلیلی بر راه اندازی مجدد مسیر طبیعی هورمونهای چرخه جنسی و بروز تخمکگذاری در PCOS باشد [24].
در مطالعهای کوچصفهانی و همکاران نشان دادند که سم زنبور عسل با اثرات آنتیاکسیدانتی و ضدالتهابی در رتهای مبتلا به تخمدان پلیکیستیک باعث افزایش تعداد فولیکولهای کوچک و پیدایش اجسام زرد در تخمدان شده است [25] . در مطالعه دیگری نشان داده شد که عصاره هیدروالکلی هسته انگور به علت خاصیت آنتیاکسیدانی و ضدالتهابی باعث افزایش تعداد جسم زرد گردید [26] . در این مطالعه نیز عصاره رازیانه احتمالاً به علت خاصیت آنتیاکسیدانی و ضدالتهابی از طریق کاهش نیتریک اکساید باعث تشکیل اجسام زرد در تخمدان پلیکیستیک شده است.
تعداد سلولهای Treg در موشهای مبتلا به PCOS نسبت به گروه کنترل کاهش معنیداری داشت (0/008=P). درمان با رازیانه تعداد سلولهای Treg را به طور معنیداری افزایش داد (0/003=P) (تصویر شماره 10).
بحث
سندرم تخمدان پلیکیستیک، شایعترین اختلال اندوکرین زنان در سنین باروری و شایعترین علت ناباروری ناشی از عدم تخمکگذاری است. مطالعات متعددی برای کاهش و جلوگیری از عوارض این بیماری صورت گرفته است [20]. در این مطالعه، اثر عصاره هیدروالکلی رازیانه بر تعدادی از فاکتورهای التهابی در مدل موشی سندرم تخمدان پلیکیستیک بررسی شد.
عدم مرگومیر و عدم تغییرات فیزیکی و فیزیولوژیک در تست سمیت حاد نشاندهنده بیخطر بودن غلظت 500 میلیگرم بر کیلوگرم عصاره رازیانه بود و ازاینرو این غلظت به عنوان غلظت درمانی به کار رفت.
القای PCOS در موشها باعث نامنظم شدن سیکلهای جنسی، افزایش معنیدار تعداد فولیکولهای کیستیک و کاهش معنیدار تعداد جسم زرد شد. این نتایج حاکی از القای موفق PCOS در مدل حیوانی مطالعه حاضر است. سیکلهای جنسی بعد از درمان با عصاره رازیانه دوباره منظم شد که نشاندهنده اثربخشی عصاره هیدروالکلی رازیانه در کاهش علائم PCOS است (تصویر شماره 11).
رازیانه گیاهی با خواص ضدالتهابی، آنتیاکسیدانی و فیتواستروژنی است [10, 11]. تجویز عصاره رازیانه به طور معنیداری، تعداد فولیکولهای کیستیک را کاهش داد.
یکی از مشخصات مهم این بیماری کاهش در میزان تخمکگذاری است و این امر باعث میشود که تعداد جسم زرد در تخمدانهای پلیکیستیک به میزان قابلتوجهی کاهش یابد. میزان پروژسترون نیز در PCOS کاهش چشمگیری دارد که علت این امر را میتوان به کاهش یا عدم جسم زرد تخمدان ربط داد [21]. مطالعات حاکی از آن است که ترکیبات فلاونوئیدی در گیاهان با فعالیت آنتیاکسیدانی میتوانند به کاهش استرس اکسیداتیو در بافت تخمدان و کاهش تعداد فولیکولهای کیستیک در این بافت منجر شوند [22].
آنتیاکسیدانهای گیاهی، عوارض ناشی از هیپرآندروژنیسم به دنبال القای PCOS در موشها را نیز کاهش میدهند [23]. خاصیت آنتیآندروژنی گیاهان نیز با القای فیدبک منفی بر (Lteinizing hormone) LH، میزان ترشح آندروژنها را کاهش میدهند. کاهش آندروژنها منجر به سنتز کمتر LH میشود و از تأثیر غالب LH بر FSH (Follicle-stimulating hormone) میکاهد که خود میتواند دلیلی بر راه اندازی مجدد مسیر طبیعی هورمونهای چرخه جنسی و بروز تخمکگذاری در PCOS باشد [24].
در مطالعهای کوچصفهانی و همکاران نشان دادند که سم زنبور عسل با اثرات آنتیاکسیدانتی و ضدالتهابی در رتهای مبتلا به تخمدان پلیکیستیک باعث افزایش تعداد فولیکولهای کوچک و پیدایش اجسام زرد در تخمدان شده است [25] . در مطالعه دیگری نشان داده شد که عصاره هیدروالکلی هسته انگور به علت خاصیت آنتیاکسیدانی و ضدالتهابی باعث افزایش تعداد جسم زرد گردید [26] . در این مطالعه نیز عصاره رازیانه احتمالاً به علت خاصیت آنتیاکسیدانی و ضدالتهابی از طریق کاهش نیتریک اکساید باعث تشکیل اجسام زرد در تخمدان پلیکیستیک شده است.
در این مطالعه میزان رادیکال آزاد NO در گروه PCOS نسبت به گروه کنترل به طور معنیداری افزایش داشت. تجویز عصاره رازیانه باعث کاهش معنیدار نیتریک اکساید نسبت به گروه PCOS شد.
تولید بیش از حد NO در رحم میتواند به التهاب و سقط جنین منجر شود [27]. استرس اکسیداتیو در مبتلایان به سندرم تخمدان پلیکیستیک نقش مهمی در تغییر ساختار فولیکولی و رشد بیشازحد بافت مزانشیم تخمدان دارد. رادیکالهای آزاد با ایجاد جهش در گیرنده هورمون FSH نیز به تغییر پاسخ فولیکولهای تخمدانی و تغییر فرآیندهای مولکولی تخمکگذاری منجر میشود [28].
نتایج این مطالعه نشان داد که تعداد سلولهای Treg در موشهای مبتلا به PCOS نسبت به گروه کنترل کاهش معنیداری داشت و تجویز عصاره رازیانه این سلولها را به طور معنیداری افزایش داد. این افزایش میتواند به علت اثر ترانس آنتول باشد که جزء اصلی رازیانه است [12].
سیستم ایمنی به واسطه فراخوانی سلولها و مولکولهای تنظیمی به مقابله با متغیرهای سلولی در بدن میپردازد و میان پاسخ ایمنی مؤثر و واکنشهای التهابی کنترلنشده تعادل برقرار میکند. یکی از سلولهای اصلی تنظیمی لنفوسیتهای Treg هستندکه نقش مهمی در جلوگیری از التهاب دارند و باعث میشوند که مادر قدرت تحمل جنین را داشته باشد. برخی از مطالعات نشان میدهد که در بیماران مبتلا به PCOS میزان Treg نسبت به افراد سالم کاهش مییابد که نتیجه آن میتواند بروز التهاب مزمن خفیف در این بیماران باشد که به عنوان یک مکانیسم جدید در پاتوژنز PCOS پیشنهاد میشود و نقش سیستم ایمنی در این بیماری را مطرح میکند [29].
نتیجهگیری
با توجه به طبیعی شدن مراحل سیکل جنسی، کاهش تعداد فولیکولهای کیستیک و افزایش جسم زرد پس از تجویز عصاره رازیانه در این مطالعه، یکی از مکانیسمهای احتمالی این تغییرات، کاهش رادیکال آزاد NO و افزایش تعداد سلولهای Treg است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
کلیه ملاحظات اخلاقی و پروتکلهای کار روی حیوانات آزمایشگاهی در این مطالعه، مورد تأیید کمیته نظارت بر حقوق حیوانات آزمایشگاهی مرکز تحقیقات دانشگاه علوم پزشکی اراک بود و با کد اخلاق IR.ARAKMU.REC.1397.312 تصویب شد.
حامی مالی
این مقاله برگرفته از پروژه تحقیقاتی با کد 3175 است. هزینه انجام این تحقیق را معاونت تحقیقات و فناوری دانشگاه علوم پزشکی اراک تأمین کرده است.
مشارکت نویسندگان
تمامی نویسندگان معیارهای استاندارد نویسندگی بر اساس پیشنهادهای کمیته بین المللی ناشران مجلات پزشکی (ICMJE) را داشتند.
تعارض منافع
طبق نظر نویسندگان هیچگونه تضاد منافعی درباره پژوهش حاضر وجود ندارد.
تشکر و قدردانی
این مقاله برگرفته از پایاننامه کارشناسی ارشد ایمنیشناسی دانشگاه علوم پزشکی اراک است. بدینوسیله از معاونت تحقیقات و شورای پژوهشی دانشگاه به دلیل تأمین مالی تشکر و قدردانی میشود.
تولید بیش از حد NO در رحم میتواند به التهاب و سقط جنین منجر شود [27]. استرس اکسیداتیو در مبتلایان به سندرم تخمدان پلیکیستیک نقش مهمی در تغییر ساختار فولیکولی و رشد بیشازحد بافت مزانشیم تخمدان دارد. رادیکالهای آزاد با ایجاد جهش در گیرنده هورمون FSH نیز به تغییر پاسخ فولیکولهای تخمدانی و تغییر فرآیندهای مولکولی تخمکگذاری منجر میشود [28].
نتایج این مطالعه نشان داد که تعداد سلولهای Treg در موشهای مبتلا به PCOS نسبت به گروه کنترل کاهش معنیداری داشت و تجویز عصاره رازیانه این سلولها را به طور معنیداری افزایش داد. این افزایش میتواند به علت اثر ترانس آنتول باشد که جزء اصلی رازیانه است [12].
سیستم ایمنی به واسطه فراخوانی سلولها و مولکولهای تنظیمی به مقابله با متغیرهای سلولی در بدن میپردازد و میان پاسخ ایمنی مؤثر و واکنشهای التهابی کنترلنشده تعادل برقرار میکند. یکی از سلولهای اصلی تنظیمی لنفوسیتهای Treg هستندکه نقش مهمی در جلوگیری از التهاب دارند و باعث میشوند که مادر قدرت تحمل جنین را داشته باشد. برخی از مطالعات نشان میدهد که در بیماران مبتلا به PCOS میزان Treg نسبت به افراد سالم کاهش مییابد که نتیجه آن میتواند بروز التهاب مزمن خفیف در این بیماران باشد که به عنوان یک مکانیسم جدید در پاتوژنز PCOS پیشنهاد میشود و نقش سیستم ایمنی در این بیماری را مطرح میکند [29].
نتیجهگیری
با توجه به طبیعی شدن مراحل سیکل جنسی، کاهش تعداد فولیکولهای کیستیک و افزایش جسم زرد پس از تجویز عصاره رازیانه در این مطالعه، یکی از مکانیسمهای احتمالی این تغییرات، کاهش رادیکال آزاد NO و افزایش تعداد سلولهای Treg است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
کلیه ملاحظات اخلاقی و پروتکلهای کار روی حیوانات آزمایشگاهی در این مطالعه، مورد تأیید کمیته نظارت بر حقوق حیوانات آزمایشگاهی مرکز تحقیقات دانشگاه علوم پزشکی اراک بود و با کد اخلاق IR.ARAKMU.REC.1397.312 تصویب شد.
حامی مالی
این مقاله برگرفته از پروژه تحقیقاتی با کد 3175 است. هزینه انجام این تحقیق را معاونت تحقیقات و فناوری دانشگاه علوم پزشکی اراک تأمین کرده است.
مشارکت نویسندگان
تمامی نویسندگان معیارهای استاندارد نویسندگی بر اساس پیشنهادهای کمیته بین المللی ناشران مجلات پزشکی (ICMJE) را داشتند.
تعارض منافع
طبق نظر نویسندگان هیچگونه تضاد منافعی درباره پژوهش حاضر وجود ندارد.
تشکر و قدردانی
این مقاله برگرفته از پایاننامه کارشناسی ارشد ایمنیشناسی دانشگاه علوم پزشکی اراک است. بدینوسیله از معاونت تحقیقات و شورای پژوهشی دانشگاه به دلیل تأمین مالی تشکر و قدردانی میشود.
References
Abinaya S, Siva D, Sabitha R, Achiraman Sh. An overview of hyperandrogenism in PCOS and the prospective underlying factors. Res J Life Sci Bioinform Pharm Chem Sci. 2019; 15(1):179-86. [DOI:10.26479/2019.0501.18]
Badawy A, Elnashar A. Treatment options for polycystic ovary syndrome. Int J Womens Health. 2011; 3:25-35. [DOI:10.2147/IJWH.S11304] [PMID] [PMCID]
Brazdova A, Senechal H, Peltre G, Poncet P. Immune aspects of female infertility. Int J Fertil Steril. 2016; 10(1):1-10. [DOI:10.22074/ijfs.2016.4762] [PMID] [PMCID]
Sugiyama H, Gyulai R, Toichi E, Garaczi E, Shimada S, Stevens SR, et al. Dysfunctional blood and target tissue CD4+CD25high regulatory T cells in psoriasis: Mechanism underlying unrestrained pathogenic effector T cell proliferation. J Immunol (Baltimore, Md : 1950). 2005; 174(1):164-73. [DOI:10.4049/jimmunol.174.1.164] [PMID] [PMCID]
Guerin LR, Prins JR, Robertson SA. Regulatory T-cells and immune tolerance in pregnancy: A new target for infertility treatment? Hum Reprod Update. 2009; 15(5):517-35. [DOI:10.1093/humupd/dmp004] [PMID] [PMCID]
Hatziagelaki E, Pergialiotis V, Kannenberg JM, Trakakis E, Tsiavou A, Markgraf DF, et al. Association between biomarkers of low-grade inflammation and sex hormones in women with polycystic ovary syndrome. Exp Clin Endocrinol Diabetes. 2019. [DOI:10.1055/a-0992-9114] [PMID]
Motta AB. Dehydroepiandrosterone to induce murine models for the study of polycystic ovary syndrome. J Steroid Biochem Mol Biol. 2010; 119(3-5):105-11. [DOI:10.1016/j.jsbmb.2010.02.015] [PMID]
Luchetti CG, Mikó E, Szekeres-Bartho J, Paz DA, Motta AB. Dehydroepiandrosterone and metformin modulate Progesterone-Induced Blocking Factor (PIBF), cyclooxygenase 2 (COX2) and cytokines in early pregnant mice. J Steroid Biochem Mol Biol. 2008; 111(3-5):200-7. [DOI:10.1016/j.jsbmb.2008.06.007] [PMID]
Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Consensus on infertility treatment related to polycystic ovary syndrome. Fertil Steril. 2008; 89(3):505-22. [DOI:10.1016/j.fertnstert.2007.09.041] [PMID]
Lee HS, Kang P, Kim KY, Seol GH. Foeniculum vulgare Mill. Protects against lipopolysaccharide-induced acute lung injury in mice through ERK-dependent NF-κB activation. Korean J Physiol Pharmacol. 2015; 19(2):183-9. [DOI:10.4196/kjpp.2015.19.2.183] [PMID] [PMCID]
Sadrefozalayi S, Farokhi F. Effect of the aqueous extract of Foeniculum vulgare (fennel) on the kidney in experimental PCOS female rats. Avicenna J Phytomed. 2014; 4(2):110-7. [PMID] [PMCID]
Zhang S, Chen X, Devshilt I, Yun Q, Huang C, An L, et al. Fennel main constituent, transanethole treatment against LPSinduced acute lung injury by regulation of Th17/Treg function. Mol Med Rep. 2018; 18(2):1369-76. [DOI:10.3892/mmr.2018.9149] [PMID] [PMCID]
Khazaei M, Montaseri A, Khazaei MR, Khanahmadi M. Study of Foeniculum vulgare effect on folliculogenesis in female mice. Int J Fertil Steril. 2011; 5(3):122-7. [PMID] [PMCID]
Saleem U, Amin S, Ahmad B, Azeem H, Anwar F, Mary S. Acute oral toxicity evaluation of aqueous ethanolic extract of Saccharum munja Roxb. roots in albino mice as per OECD 425 TG. Toxicol Rep. 2017; 4:580-5. [DOI:10.1016/j.toxrep.2017.10.005] [PMID] [PMCID]
Salimi-Asl M, Mozdarani H, Kadivar M. Up-regulation of miR-21 and 146a expression and increased DNA damage frequency in a mouse model of Polycystic Ovary Syndrome (PCOS). BioImpacts: BI. 2016; 6(2):85-91. [DOI:10.15171/bi.2016.12] [PMID] [PMCID]
Sadoughi SD. [Effects of crocin on ovarian follicle and serum sex hormone in letrozole-induced polycystic ovarian syndrome in rat model (Persian)]. J Ardabil Univ Med Sci. 2017; 17(2):198-210. http://jarums.arums.ac.ir/article-1-1377-en.html
Mosayebi G, Ghazavi A, Khazaei MR, Payani MA. [Effect of vitamin E on the inhibition of experimental autoimmune encephalomyelitis in C57BL/6 mouse (Persian)]. J Arak Univ Med Sci. 2006; 9(1):68-75. http://jams.arakmu.ac.ir/article-1-259-fa.html
Palizvan MR, Khademi Sh, Ghazavi A, Mosayebi Gh. [Correlation of two way active avoidance learning with Nitric Oxide and Ferric reduction/antioxidant power in rats (Persian)]. J Arak Univ Med Sci. 2006; 9(4):1-8. http://jams.arakmu.ac.ir/article-1-61-fa.html
Nasri F, Doroudchi M, Namavar Jahromi B, Gharesi-Fard B. T helper cells profile and CD4+CD25+Foxp3+Regulatory T cells in polycystic ovary syndrome. Iran J Immunol. 2018; 15(3):175-85. [DOI:10.22034/IJI.2018.39387] [PMID]
Pahlevani P, Mosavi SM, Rastgoo Haghi AR, Lahotian H, Esna Ashari F, Alizadeh Z. [Study of the effects of stachys lvandulifolia alcoholic extract on histomorphometry of endometrium in polycystic ovarian syndrome rat model (Persian)]. Avicenna J Clin Med. 2016; 23(1):40-8. http://sjh.umsha.ac.ir/article-1-855-en.html
Padua MB, Tekin Ş, Spencer TE, Hansen PJ. Actions of progesterone on uterine immunosuppression and endometrial gland development in the Uterine Gland Knockout (UGKO) ewe. Mol Reprod Dev. 2005; 71(3):347-57. [DOI:10.1002/mrd.20301] [PMID]
Yilmaz N, Inal HA, Gorkem U, Yilmaz S, Sargin A, Turkkani A. Follicular fluid total antioxidant capacity in patient with PCOS. Fertil Steril. 2013; 100(Suppl. 3):S356. [DOI:10.1016/j.fertnstert.2013.07.838]
Ahmadi A, Mostafavi M, Kalantari Hesari A. [Histological studies of the effect of licorice root hydroalcoholic extract on the structure of polycystic ovary syndrome in mice following hyperandrogenism induced by letrozole (Persian)]. Stud Med Sci. 2019; 29(12):857-68. http://umj.umsu.ac.ir/article-1-4603-en.html
Armanini D, Mattarello MJ, Fiore C, Bonanni G, Scaroni C, Sartorato P, et al. [Licorice reduces serum testosterone in healthy women (Persian)]. Steroids. 2004; 69(11-12):763-6. [DOI:10.1016/j.steroids.2004.09.005] [PMID]
Mohseni Kouchesfahani H, Nabyooni M, Adham H. [Investigating the therapeutic effect of Bee venom on polycystic ovarian syndrome in rats (Persian)]. Pejouhandeh. 2010; 15(1):1-6. http://pajoohande.sbmu.ac.ir/article-1-868-en.html
Mohseni Kouchesfahani H, Parivar K, Salmabadi Z. [Effect of hydroalcoholic grape seed extract (Vitis vinifera L.) on polycystic ovarian syndrome in female Wistar rat (Persian)]. J Cell Tissue. 2015; 6(2):153-64. https://www.sid.ir/fa/journal/ViewPaper.aspx?ID=265203
Cella M, Farina MG, Dominguez Rubio AP, Di Girolamo G, Ribeiro ML, Franchi AM. Dual effect of nitric oxide on uterine prostaglandin synthesis in a murine model of preterm labour. Br J Pharmacol. 2010; 161(4):844-55. [DOI:10.1111/j.1476-5381.2010.00911.x] [PMID] [PMCID]
Sekhon LH, Gupta S, Kim Y, Agarwal A. Female infertility and antioxidants. Curr Womens Health Rev. 2010; 6(2):84-95. [DOI:10.2174/157340410791321381]
Krishna MB, Joseph A, Subramaniam AG, Gupta A, Pillai SM, Laloraya M. Reduced Tregs in peripheral blood of PCOS patients - a consequence of aberrant Il2 signaling. J Clin Endocrinol Metab. 2015; 100(1):282-92. [DOI:10.1210/jc.2014-2401] [PMID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |