BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
URL: http://jams.arakmu.ac.ir/article-1-6276-fa.html
2- گروه ژنتیک، دانشکده علوم پایه، واحد کازرون، دانشگاه آزاد اسلامی، کازرون، ایران. ،
مقدمه
تحقیقات متعدد انجامشده در سراسر جهان و چند مطالعه محدود انجامشده در ایران برای شناسایی عوامل خطر این بیماری، نشان دادهاند همچون سایر سرطانهای دیگر، سبک زندگی در بروز آن تاثیر بسزایی دارد. نوع تغذیه، میزان استرس، ضعف سیستم ایمنی، مصرف دخانیات، نوع شغل، تماس با مواد شیمیایی و عوامل ژنتیکی از جمله عوامل شناختهشده مؤثر در بروز این نوع سرطان هستند. اما عمده تاکید پژوهشگران و درمانگران در تحقیقات اخیر صورتگرفته در این حوزه، بر نقش عوامل ژنتیکی در بروز لوسمی حاد میلوئیدی است [8]. از جمله عوامل ژنتیکی دخیل، وجود چندشکلیهای تکنوکلئوتیدی است که تفاوتهای فردی برای مستعد شدن در برابر نئوپلاسمهای خاص را توضیح میدهد [9]. چندشکلیهای یک جایگاه ژنی بیانکننده پروتئینهای دخیل در تکامل و فعال شدن سلولهای میلوئیدی میتوانند در عدم بلوغ این سلولها نقش داشته باشند.
ژن ZAP-70 واقع در موقعیت کروموزومی 2q11.2، دستورالعمل ساخت پروتئینکیناز وابسته به زنجیره زتا را فراهم میکند که به طور طبیعی روی سلولهای NK و T بیان میشود و جزئی از مسیر پیامرسانی تکامل و فعال شدن سلولهای خونی را هدایت مینماید. پروتئین فسفوترانسفرازی ZAP-70در مسیر سیگنالی تکامل سلول، به تیروزینهای فسفریلهشده زنجیره زتا به واسطه ITAM، متصل شده و فعال میشود. سپس ZAP-70 فعال، تیروزینهای ملکولهای آداپتور مختلف نظیر LAT را فسفریله میکند [10، 11] (شکل شماره 1). در ادامه، ملکولهای آداپتور با ایفای نقش به عنوان محلهایی برای لنگراندازی آنزیمهایی نظیر PLCγ1 و دیگر فاکتورهای فعالکننده مسیرهای بالادستی، روند تکامل و فعالسازی سلول را پیش میبرند [12]. تا کنون 8340 چندشکلی تکنوکلئوتیدی در ناحیه ژنی ZAP-70 شناسایی شده است و مطالعات فراوانی به نقش پروتئین ZAP-70 در بیماریهای خودایمن و سرطانهای مختلف اشاره کردهاند. برای مثال مطالعهای در سال 2010، ZAP-70 را تیروزینکینازی دارای نقش حیاتی در تکامل و بیماریها معرفی کرده است [10]. در سال 2014، طی یک بررسی مشخص شد ZAP-70 در تبدیل لوسمی لنفوسیتی مزمن به لنفومای تهاجمی B سل نقش دارد [13]. نقش ZAP-70 در بروز لوسمی لنفوسیتی حاد نیز در سال 2017 طی مطالعهای گزارش شده است [14].
rs104893674(A/C) از چندشکلیهای تکنوکلئوتیدی ژن ZAP-70 است که به خاطر قرارگیری در داخل اگزون میتواند مستقیماً باعث افزایش یا کاهش عملکرد ژن و متعاقب آن افزایش یا کاهش استعداد ابتلا به بیماریها شود. از طرفی تا کنون ارتباط آن با لوسمی میلوئیدی مورد بررسی قرار نگرفته است، بنابراین مطالعه حاضر با هدف بررسی ارتباط این چندشکلی با خطر ابتلا به لوسمی میلوئیدی حاد انجام شد.
مواد و روشها
.png)
پس از اخذ رضایتنامه از افراد مورد مطالعه و پر کردن پرسشنامه، 5 میلیلیتر خون محیطی در لولههای حاوی EDTA جمعآوری شد. پس از جمعآوری کلیه نمونهها، DNA به روش Salting out توسط کیت شرکت GeNet Bio ساخت کره جنوبی استخراج شد. سپس DNA استخراجشده در تیوبهای 1/5 میلیلیتری جمعآوری شد و به فریزر در دمای منهای 20 درجه سانتیگراد منتقل شد. در ادامه، کیفیت DNA استخراجشده روی ژل آگارز 1 درصد مشخص شد و تعیین پلیمورفیسم (A/C)rs104893674 با استفاده از روش Tetra Primer ARMS PCR در حضور آغازگر که براساس توالی ژن مربوطه توسط نرمافزارهای ملکولی Oligo 7 و Blast طراحی و سپس توسط شرکت Macrogen سنتز شده بود، انجام گرفت (جدول شماره 2).
.png)
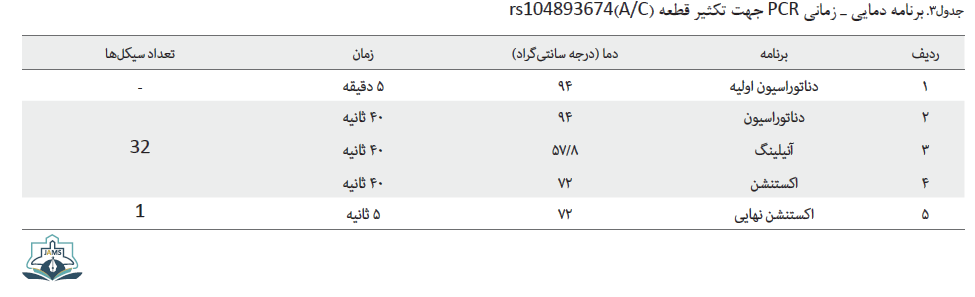
مخلوط واکنش PCR در حجم نهایی 22 میکرولیتر شامل 5 میکرولیتر H2O (آب مقطر استریل)، یک میکرولیتر (10 پیکومول) از هر پرایمر کنترل رفت، کنترل برگشت، پرایمر برگشت و پرایمر آللهای C و A، 11 میکرولیتر مسترمیکس 2x PCR Master Mix Red. Mg cl2 (Ampliqon, Odense, Denmark) و یک میکرولیتر DNA ژنومیک آماده شد و تحت برنامه دمای - زمانی مربوطه قرار گرفت (جدول شماره 3).
محصول PCR، برای آلل C و A روی ژل آگارز 2 درصد در ولتاژ 100 ولت به مدت 35 دقیقه الکتروفورز شد و باندهای ظاهرشده با استفاده از Klac CD Gel Documentation System مشاهده شدند (تصویر شماره 1).
.png)
تجزیه و تحلیل دادهها با کمک نرمافزار SPSS نسخه 23 و آزمون آماری مجذور کای صورت گرفت.
یافتهها
نتایج ARMS-PCR
مقایسه فراوانی آللهای A و C در موقعیت پلیمورفیسمی rs104893674 در بیماران و گروه کنترل
نتایج حاصل از آزمون مجذور کای ارتباط معنیداری را بین گروه کنترل و بیمار در فراوانی هر دو آلل A و C در موقعیت پلیمورفیسمی rs104893674 نشان داد (P=0/000). نتایج شانس ابتلای 2/19 برابری برای لوسمی میلوئیدی حاد را در نتیجه حضور آلل A در این جایگاه چندشکلی اثبات کرد (2/19= OR) (جدول شماره 4).

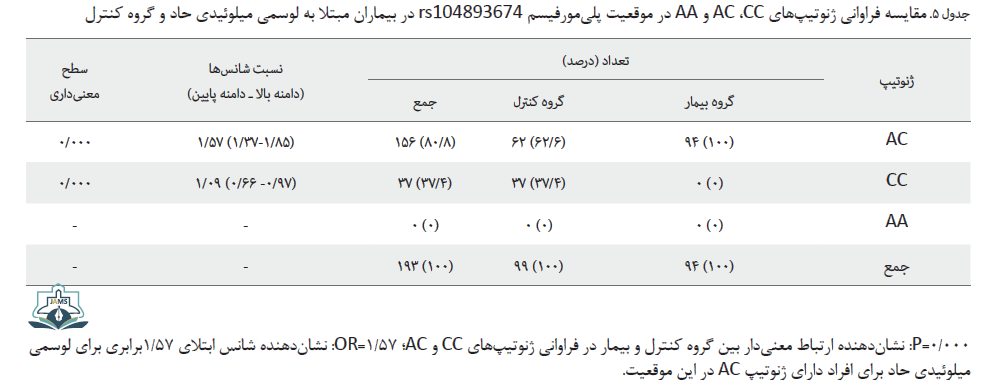
مقایسه فراوانی ژنوتیپهای CC، AC و AA پلیمورفیسم rs104893674 در بیماران و گروه کنترل
نتایج حاصل از آزمون مجذور کای ارتباط معنیداری را بین گروه کنترل و بیمار در فراوانی ژنوتیپهای CC و AC در موقعیت پلیمورفیسمی rs104893674 نشان داد (P=0/000). در بین نمونهها ژنوتیپ AA مشاهده نشد. شانس 1/57 برابری ابتلا به لوسمی میلوئیدی حاد برای افراد دارای ژنوتیپ AC در این موقیعت ژنتیکی تعیین شد (1/57=OR) (جدول شماره 5).
بحث
نتیجهگیری
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
حامی مالی
مشارکت نویسندگان
تعارض منافع
تشکر و قدردانی
References
1.Babaei M, Mousavi S, Malek M, Tosi G, Zolfaghari M, Danaei N, et al. Cancer occurrence in Semnan Province, Iran: Results of a population-based cancer registry. Asian Pac J Cancer Prev. 2005; 6(2):159-64. http://eprints.semums.ac.ir/860/1/APJCP_Volume_6_Issue_2_Pages_159-164.pdf
2.Zand AM, Imani S, Sa’adati M, Borna H, Ziaei R, Honari H. [Effect of age, gender and blood group on blood cancer types (Persian)]. Kowsar Med J. 2010; 15(2):111-4. https://www.sid.ir/en/Journal/ViewPaper.aspx?ID=175155
3.Robin KO, Mervin CY. Hematology, immunology and infectious disease: neonatology questions and controversies. 1th ed. Philadelphia: Saunders; 2008. https://www.elsevier.com/books/hematology-immunology-and-infectious-disease-neonatology-questions-and-controversies/ohls/978-1-4160-3158-1
4.Kupsa T, Horacek JM, Jebavy L. The role of cytokines in acute myeloid leukemia: A systematic review. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2012; 156(4):291-301. [DOI:10.5507/bp.2012.108] [PMID]
5.Fauci AS, Hauser SL, Kasper DL, Longo DL, Jameson JL, Loscalzo J. Oncology and hematology. Harrison’s principles of internal medicine. 19th ed. New York: McGraw Hill Education; 2015. https://www.worldcat.org/title/harrisons-principles-of-internal-medicine/oclc/907408102#details-allauthors
6.Steffen B, Muller-Tidow C, Schwable J, Berdel WE, Serve H. The molecular pathogenesis of acute myeloid leukemia. Crit Rev Oncol Hematol. 2005; 56(2):195-221. [DOI:10.1016/j.critrevonc.2004.10.012] [PMID]
7.Parkin DM, Whelan SL, Ferlay J, Teppo L, Thomas DB. Cancer incidence in five continents. IARC Sci Publ. 2002; 8(155). https://publications.iarc.fr/Book-And-Report-Series/Iarc-Scientific-Publications/Cancer-Incidence-In-Five-Continents-Volume-VIII-2002
8.Saffar A, Rahgozar M, Shahi F, Biglarian A. [Survival analysis of acute myeloid leukemia (Persian)]. Iran Uni Med Sci. 2015; 22(134):41-8. http://rjms.iums.ac.ir/article-1-3921-en.html
9.Chang FH, Tzeng DS, Lee TM, Chen TC, Hsu LS, Lung FW. Mutations in the p53 tumor suppressor gene in colorectal cancer in Taiwan. Kaohsiung J Med Sci. 2003; 19(4):151-8. [DOI:10.1016/S1607-551X(09)70464-4] [PMID]
10.Wang H, Kadlecek TA, Au-Yeung BB, Goodfellow HES, Hsu LY, Freedman TS. ZAP-70: An essential kinase in T-cell signaling. Cold Spring Harb Perspect Biol. 2010; 2(5):a002279. [DOI:10.1101/cshperspect.a002279] [PMID] [PMCID]
11.Smith-Garvin JE, Koretzky GA, Jordan MS. T cell activation. Annu Rev Immunol. 2009; 27:591-619. [DOI:10.1146/annurev.immunol.021908.132706] [PMID] [PMCID]
12.Morrison DK. MAP kinase pathways. Cold Spring Harb Perspect Biol. 2012; 4(11):a011254. [DOI:10.1101/cshperspect.a011254] [PMID] [PMCID]
13.Parikh SA, Shanafelt TD. Risk factors for Richter syndrome in chronic lymphocytic leukemia. Curr Hematol Malig Rep. 2014; 9(3):294-9. [DOI:10.1007/s11899-014-0223-4] [PMID]
14.Alsadeq A, Fedders H, Vokuhl C, Belau NM, Zimmermann M, Wirbelauer T, et al. The role of ZAP70 kinase in acute lymphoblastic leukemia infiltration into the central nervous system. Haematologica. 2017; 102(2):346-55. [DOI:10.3324/haematol.2016.147744] [PMID] [PMCID]
15.Torkaman A, Moghaddam Charkari N, Aghaeipour M. An approach for leukemia classification based on cooperative game theory. Anal Cell Pathol (Amst). 2011; 34(5):235-46. [DOI:10.1155/2011/212174] [PMCID]
16.Ferjeni Z, Bouzid D, Fourati H, Stayoussef M, Abida O, Kammoun T, et al. Association of TCR/CD3, PTPN22, CD28 and ZAP70 gene polymorphisms with type 1 diabetes risk in Tunisian population: Family based association study. Immunol Lett. 2015; 163(1):1-7. [DOI:10.1016/j.imlet.2014.11.005] [PMID]
17.Chen S-Y, Liu M-F, Wang C-R. Genetic polymorphism of 3′ untranslated region of zeta-chain associated protein kinase 70 kDa in southern Taiwanese patients with rheumatoid arthritis. Clinical rheumatology. 2016; 35(3):747-50. [DOI:10.1007/s10067-015-3044-5] [PMID]
18.Chinn IK, Sanders RP, Stray-Pedersen A, Coban-Akdemir ZH, Kim VH-D, Dadi H, et al. Novel combined immune deficiency and radiation sensitivity blended phenotype in an adult with biallelic variations in ZAP70 and RNF168. Front Immunol. 2017; 8:576. [DOI:10.3389/fimmu.2017.00576] [PMID] [PMCID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |









