دوره 25، شماره 2 - ( خرداد و تیر 1401 )
جلد 25 شماره 2 صفحات 229-214 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Soleimani A, Fathi M. Effect of Four Weeks of Ginger Supplementation Followed by Acute Eccentric and Concentric Training on Irisin and Insulin Levels, Insulin Resistance Index, and Lipid Profile of Young Women With Obesity: A Randomized Clinical trial. J Arak Uni Med Sci 2022; 25 (2) :214-229
URL: http://jams.arakmu.ac.ir/article-1-7205-fa.html
URL: http://jams.arakmu.ac.ir/article-1-7205-fa.html
سلیمانی اسما، فتحی محمد. تأثیر 4 هفته مصرف مکمل زنجبیل بر هورمون آیریزین، انسولین، شاخص مقاومت انسولین و نیمرخ لیپیدی دختران چاق به دنبال فعالیت حاد برونگرا و درونگرا. مجله دانشگاه علوم پزشكي اراك. 1401; 25 (2) :214-229
1- گروه فیزیولوژی ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه لرستان، خرم آباد، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه لرستان، خرم آباد، ایران. ،fathi.m@lu.ac.ir
2- گروه فیزیولوژی ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه لرستان، خرم آباد، ایران. ،
متن کامل [PDF 2398 kb]
(1336 دریافت)
| چکیده (HTML) (3606 مشاهده)
References
1.Zou C, Shao J. Role of adipocytokines in obesity-associated insulin resistance. J Nutr Biochem. 2008; 19(5):277-86. [DOI:10.1016/j.jnutbio.2007.06.006] [PMID]
2.Batsis JA, Nieto-Martinez RE, Lopez-Jimenez F. Metabolic syndrome: From global epidemiology to individualized medicine. Clin Pharmacol Ther. 2007; 82(5):509-24. [DOI:10.1038/sj.clpt.6100355] [PMID]
3.World Health Organization (WHO). Obesity and overweight. Geneva: World Health Organization; 2016. [Link]
4.Patel S, Hoehn K, Lawrence R, Sawbridge L, Talbot N, Tomsig J, et al. Overexpression of the adiponectin receptor AdipoR1 in rat skeletal muscle amplifies local insulin sensitivity. Endocrinology. 2012; 153(11):5231-46. [DOI:10.1210/en.2012-1368] [PMID] [PMCID]
5.Pedersen BK. A muscular twist on the fate of fat. N Engl J Med. 2012; 366(16):1544-5. [DOI:10.1056/NEJMcibr1201024] [PMID]
6.Pedersen BK, Febbraio MA. Muscles, exercise and obesity: Skeletal muscle as a secretory organ. Nat Rev Endocrinol. 2012; 8(8):457-65. [DOI:10.1038/nrendo.2012.49] [PMID]
7.Boström P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature. 2012; 481(7382):463-8. [DOI:10.1038/nature10777] [PMID] [PMCID]
8.Arias-Loste MT, Ranchal I, Romero-Gómez M, Crespo J. Irisin, a link among fatty liver disease, physical inactivity and insulin resistance. Int J Mol Sci. 2014; 15(12):23163-78. [DOI:10.3390/ijms151223163] [PMID] [PMCID]
9.Wu J, Ruas JL, Estall JL, Rasbach KA, Choi JH, Ye L, e al. The unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1α/ATF6α complex. Cell Metab. 2011; 13(2):160-9. [DOI:10.1016/j.cmet.2011.01.003] [PMID] [PMCID]
10.Moreno-Navarrete JM, Ortega F, Serrano M, Guerra E, Pardo G, Tinahones F, et al. Irisin is expressed and produced by human muscle and adipose tissue in association with obesity and insulin resistance. J Clin Endocrinol Metab. 2013; 98(4):E769-78. [DOI:10.1210/jc.2012-2749] [PMID]
11.Zeppetzauer M, Drexel H, Vonbank A, Rein P, Aczel S, Saely CH. Eccentric endurance exercise economically improves metabolic and inflammatory risk factors. Eur J Prev Cardiol. 2013; 20(4):577-84. [DOI:10.1177/2047487312444236] [PMID]
12.Paschalis V, Nikolaidis MG, Theodorou AA, Panayiotou G, Fatouros IG, Koutedakis Y, et al. A weekly bout of eccentric exercise is sufficient to induce health-promoting effects. Med Sci Sports Exerc. 2011; 43(1):64-73. [DOI:10.1249/MSS.0b013e3181e91d90] [PMID]
13.Wojtaszewski JF, Nielsen JN, Richter EA. Invited review: Effect of acute exercise on insulin signaling and action in humans. J Appl Physiol. 2002; 93(1):384-92. [DOI:10.1152/japplphysiol.00043.2002] [PMID]
14.Kirwan J, Del Aguila L. Insulin signalling, exercise and cellular integrity. Biochem Soc Trans. 2003; 31(Pt 6):1281-5. [DOI:10.1042/bst0311281] [PMID]
15.Wang J, Ke W, Bao R, Hu X, Chen F. Beneficial effects of ginger Zingiber officinale roscoe on obesity and metabolic syndrome: A review. Ann N Y Acad Sci. 2017; 1398(1):83-98. [DOI:10.1111/nyas.13375] [PMID]
16.Zaer Ghodsi N, Zolfaghari MR, Fattah A. The impact of high intensity interval training on lipid profile, inflamematory markers and anthropometric parameters in inactive women. Med Lab J. 2016; 10(1):56-60. [DOI:10.18869/acadpub.mlj.10.1.56]
17.Löffler D, Müller U, Scheuermann K, Friebe D, Gesing J, Bielitz J, et al. Serum irisin levels are regulated by acute strenuous exercise. J Clin Endocrinol Metab. 2015; 100(4):1289-99. [DOI:10.1210/jc.2014-2932] [PMID]
18.Tsuchiya Y, Ando D, Goto K, Kiuchi M, Yamakita M, Koyama K. High-intensity exercise causes greater irisin response compared with low-intensity exercise under similar energy consumption. Tohoku J Exp Med. 2014; 233(2):135-40. [DOI:10.1620/tjem.233.135] [PMID]
19.Daskalopoulou SS, Cooke AB, Gomez YH, Mutter AF, Filippaios A, Mesfum ET, et al. Plasma irisin levels progressively increase in response to increasing exercise workloads in young, healthy, active subjects. Eur J Endocrinol. 2014; 171(3):343-52. [DOI:10.1530/EJE-14-0204] [PMID]
20.Verma SK, Singh M, Jain P, Bordia A. Protective effect of ginger, zingiber officinale Rosc on experimental atherosclerosis in rabbits. Indian J Exp Biol. 2004; 42(7):736-8. [PMID]
21.Shirdel Z, Mirbalad Zade R, Madani H. [Effect of anti diabetic and anti lipidemic of ginger in diabetic rats for aloxan mono hidrate and compare with gliben clamid (Persian)]. Iran J Diabetes Metab. 2009; 9(1):7-15. [Link]
22.Pollock ML, Foster C, Schmidt D, Hellman C, Linnerud AC, Ward A. Comparative analysis of physiologic responses to three different maximal graded exercise test protocols in healthy women. Am Heart J. 1982; 103(3):363-73. [DOI:10.1016/0002-8703(82)90275-7] [PMID]
23.Ellestad MH, Allen W, Wan MC, Kemp GL. Maximal treadmill stress testing for cardiovascular evaluation. Circulation. 1969; 39(4):517-22. [DOI:10.1161/01.CIR.39.4.517] [PMID]
24.Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: Insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985; 28(7):412-9. [DOI:10.1007/BF00280883] [PMID]
25.Ahn EK, Oh JS. Inhibitory effect of galanolactone isolated from Zingiber officinale roscoe extract on adipogenesis in 3T3-L1 cells. J Korean Soc Appli Biol Chem. 2012; 55:63-8. [DOI:10.1007/s13765-012-0011-6]
26.Racil G, Ben Ounis O, Hammouda O, Kallel A, Zouhal H, Chamari K, et al. Effects of high vs. moderate exercise intensity during interval training on lipids and adiponectin levels in obese young females. Eur J Appl Physiol. 2013; 113(10):2531-40. [DOI:10.1007/s00421-013-2689-5] [PMID]
27.Huh JY, Panagiotou G, Mougios V, Brinkoetter M, Vamvini MT, Schneider BE, et al. FNDC5 and irisin in humans: I. predictors of circulating concentrations in serum and plasma and II. mRNA expression and circulating concentrations in response to weight loss and exercise. Metabolism. 2012; 61(12):1725-38. [DOI:10.1016/j.metabol.2012.09.002] [PMID] [PMCID]
28.Hecksteden A, Wegmann M, Steffen A, Kraushaar J, Morsch A, Ruppenthal S, et al. Irisin and exercise training in humans-results from a randomized controlled training trial. BMC Med. 2013; 11:235. [DOI:10.1186/1741-7015-11-235] [PMID] [PMCID]
29.Shoukry A, Shalaby SM, El-Arabi Bdeer S, Mahmoud AA, Mousa MM, Khalifa A. Circulating serum irisin levels in obesity and type 2 diabetes mellitus. IUBMB Life. 2016; 68(7):544-56. [DOI:10.1002/iub.1511] [PMID]
30.Brahma Naidu P, Uddandrao VV, Ravindar Naik R, Suresh P, Meriga B, Begum MS, et al. Ameliorative potential of gingerol: Promising modulation of inflammatory factors and lipid marker enzymes expressions in HFD induced obesity in rats. Mol Cell Endocrinol. 2016; 419:139-47. [DOI:10.1016/j.mce.2015.10.007] [PMID]
31.Gao H, Guan T, Li C, Zuo G, Yamahara J, Wang J, et al. Treatment with ginger ameliorates fructose-induced fatty liver and hypertriglyceridemia in rats: Modulation of the hepatic carbohydrate response element-binding protein-mediated pathway. Evid Based Complement Alternat Med. 2012; 2012:570948. [DOI:10.1155/2012/570948] [PMID] [PMCID]
32.Zhu J, Chen H, Song Z, Wang X, Sun Z. Effects of ginger (Zingiber officinale roscoe) on type 2 diabetes mellitus and components of the metabolic syndrome: A systematic review and meta-analysis of randomized controlled trials. Evid Based Complement Alternat Med. 2018; 2018:5692962. [DOI:10.1155/2018/5692962] [PMID] [PMCID]
33.Paoli A, Pacelli QF, Moro T, Marcolin G, Neri M, Battaglia G, et al. Effects of high-intensity circuit training, low-intensity circuit training and endurance training on blood pressure and lipoproteins in middle-aged overweight men. Lipids Health Dis. 2013; 12:131. [DOI:10.1186/1476-511X-12-131] [PMID] [PMCID]
34.Hovanloo F, Shahvali Koohshoori Y, Teimoorian M, Saadati M, Fallah Huseini H. The effect of aerobic training combined and green tea (camellia sinensis l.) extract consumption on blood glucose and lipid profile in streptozotocin induced diabetic rats. J Med Plants. 2014; 13(51):84-92. [Link]
35.Elmer D. Effect of 8 weeks of high-intensity interval training versus traditional endurance training on the blood lipid profile in humans [PhD thesis]. Auburn: AUBURN University; 2013. [Link]
36.ElRokh el-SM, Yassin NA, El-Shenawy SM, Ibrahim BM. Antihypercholesterolaemic effect of ginger rhizome (Zingiber officinale) in rats. Inflammopharmacology. 2010; 18(6):309-15. [DOI:10.1007/s10787-010-0053-5] [PMID]
37.Lee JO, Kim N, Lee HJ, Moon JW, Lee SK, Kim SJ, et al. [6]-gingerol affects glucose metabolism by dual regulation via the AMPKα2-mediated AS160-Rab5 pathway and AMPK-mediated insulin sensitizing effects. J Cell Biochem. 2015; 116(7):1401-10. [DOI:10.1002/jcb.25100] [PMID]
38.Madkor HR, Mansour SW, Ramadan G. Modulatory effects of garlic, ginger, turmeric and their mixture on hyperglycaemia, dyslipidaemia and oxidative stress in streptozotocin-nicotinamide diabetic rats. Br J Nutr. 2011; 105(8):1210-7. [DOI:10.1017/S0007114510004927] [PMID]
39.Priya Rani M, Padmakumari KP, Sankarikutty B, Lijo Cherian OL, Nisha VM, Raghu KG. Inhibitory potential of ginger extracts against enzymes linked to type 2 diabetes, inflammation and induced oxidative stress. Int J Food Sci Nutr. 2011; 62(2):106-10. [DOI:10.3109/09637486.2010.515565] [PMID]
40.Wei CK, Tsai YH, Korinek M, Hung PH, El-Shazly M, Cheng YB, et al. 6-Paradol and 6-Shogaol, the pungent compounds of ginger, promote glucose utilization in adipocytes and myotubes, and 6-Paradol reduces blood glucose in high-fat diet-fed mice. Int J Mol Sci. 2017; 18(1):168. [DOI:10.3390/ijms18010168] [PMID] [PMCID]
41.Rani MP, Krishna MS, Padmakumari KP, Raghu KG, Sundaresan A. Zingiber officinale extract exhibits antidiabetic potential via modulating glucose uptake, protein glycation and inhibiting adipocyte differentiation: An in vitro study. J Sci Food Agric. 2012; 92(9):1948-55. [DOI:10.1002/jsfa.5567] [PMID]
42.Li Y, Tran VH, Duke CC, Roufogalis BD. Gingerols of Zingiber officinale enhance glucose uptake by increasing cell surface GLUT4 in cultured L6 myotubes. Planta Med. 2012; 78(14):1549-55. [DOI:10.1055/s-0032-1315041] [PMID]
43.Ghanbari-Niaki A, Saghebjoo M, Soltani R, Kirwan JP. Plasma visfatin is increased after high-intensity exercise. Ann Nutr Metab. 2010; 57(1):3-8. [DOI:10.1159/000313936] [PMID]
44.Philippe M, Krüsmann PJ, Mersa L, Eder EM, Gatterer H, Melmer A, et al. Acute effects of concentric and eccentric exercise on glucose metabolism and interleukin-6 concentration in healthy males. Biol Sport. 2016; 33(2):153-8. [DOI:10.5604/20831862.1198634] [PMID] [PMCID]
45.Patti ME, Butte AJ, Crunkhorn S, Cusi K, Berria R, Kashyap S, et al. Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes: Potential role of PGC1 and NRF1. Proc Natl Acad Sci U S A. 2003; 100(14):8466-71. [DOI:10.1073/pnas.1032913100] [PMID] [PMCID]
46.Timmons JA, Baar K, Davidsen PK, Atherton PJ. Is irisin a human exercise gene? Nature. 2012; 488(7413):E9-10; discussion E10-1. [DOI:10.1038/nature11364] [PMID]
47.Yang Z, Chen X, Chen Y, Zhao Q. Decreased irisin secretion contributes to muscle insulin resistance in high-fat diet mice. Int J Clin Exp Pathol. 2015; 8(6):6490-7. [PMID] [PMCID]
متن کامل: (2005 مشاهده)
مقدمه
چاقی مشکل اساسی در بهداشت عمومی و یک عامل زمینهایی در بسیاری از بیماری های مزمن و اختلالات مختلف میباشد [1 ,2]. طبق گزارش سازمان بهداشت جهانی در سال 2014، 39 درصد بزرگسالان دارای اضافه وزن و 13 درصد آنان چاق بودند [3]. منظور از چاقی حالتی است که در آن، بدن شخص دارای چربی بیش از اندازه باشد. در سالهای اخیر، تعامل بین بافتهای چربی و عضله بهطور فزایندهای شناسایی شده است که مربوط به ادیپوکینهای مترشحه از عضلات است که نقش مهمی در تنظیم وزن و چاقی دارند [4]. فعالیت بدنی باعث تحریک تولید مایوکینها میشود که دارای عملکرد مختلفی در عضلات اسکلتی، بافت چربی و رگهای خونی هستند [5, 6].
آیریزین یک مایوکاین جدید و محصول ژن FNDS است که بهطور عمده در عضلات تولید و توسط ژن PGC-1 تنظیم میشود و بهعنوان فاکتور میانجی اثرات مفید تمرینات ورزشی بر متابولیسم شناخته میشود که دارای خودتنظیمی مثبت میباشد [7]. همچنین آیریزین میتواند با بهبود متابولیسم لیپید و گلوکز و افزایش مصرف انرژی، موجب کاهش وزن شود [8]. اگرچه فعالیت ورزشی منظم بهواسطه افزایش هزینه انرژی، تسریع و بهبود اکسیداسیون چربیها، باعث کاهش عوامل خطرزای بسیاری از بیماریها میشود، اما مکانیسم دقیق افزایش هزینه انرژی ناشی از ورزش، همچنان نامشخص است [9]. تغییر فنوتیپ بافت چربی بر اثر تمرین تئوری جدیدی است که بهتازگی مطرح شده است، اما سازوکار سلولی مولکولی آن در حال بررسی است. بافت چربی به دو صورت بافت چربی سفید و بافت چربی قهوهای مشخص شده است. بافت چربی سفید بهعنوان مسئول اصلی ذخیرهسازی چربی و انرژی و بافت چربی قهوهای بهدلیل تنفس خارجی میتوکندری میتواند انرژی را بهصورت گرما انتقال دهد [10].
در مطالعه بوستروم و همکاران مشخص شد که فعالیت بدنی با افزایش بیان ژن PGC1a در عضله، باعث افزایش پروتئین غشایی FNDC5 و درنهایت ترشح هورمونی بنام آیریزین میشود. آیریزین بهعنوان یک مایوکاین عمل میکند و با افزایش بیان ژن پروتئین UCP1 در میتوکندریهای سلولهای چربی موجب تبدیل بافتهای چربی سفید به قهوهای میشود. درنتیجه با افزایش فرایند گرمازایی باعث بهبود تحمل گلوکز، افزایش حساسیت به انسولین، کاهش در وزن بدن و کاهش توده چربی در موشها میشود [7] بااینحال، تناقضات در مورد ارتباط آیریزین در انسان بهویژه در پیشگیری و درمان چاقی وجود دارد. برخی از مطالعات انسانی گزارش کردهاند که یک همبستگی مثبت بین سطوح پایه در گردش آیریزین یا بیان FNDC5 mRNA و شاخص توده بدن وجود دارد [7]. درحالیکه مطالعات دیگر یک ارتباط منفی بین آیریزین در گردش با شاخص توده بدن یافتند [7].
هرچند اطلاعات مطالعات انسانی محدود هستند، اما مشخص شد ورزش باعث افزایش قابل توجهی در غلظت آیریزین میشود [7]. اخیراً مشخص شد تمرین برونگرا و درونگرا بر روی تردمیل اثرات مشابهی در بهبود متابولیسم گلوکز و چربیها در افراد سالم غیرفعال دارد [11]. افراد غیرفعال گروههایی هستند که هیچگونه فعالیت ورزشی ندارند. اگرچه آنها با استفاده از پروتکلهای مختلف مشخص کردند که تمرین با شیب منفی ازطریق افزایش سیگنالینگ و بهبود عمل انسولین باعث تعدیل مثبت مقاومت به انسولین و تحمل گلوکز در زنان و مردان میشود [12]، درحالیکه یک جلسه تمرین استقامتی درونگرا بهطور کلی با بهبود فعالیت انسولین و انتقال گلوکز همراه است [13]. بسیاری از مطالعات نشان میدهند که آسیب عضلانی ناشی از تمرین غیرعادی برونگرا ممکن است اثرات منفی بر متابولیسم گلوکز بگذارد [14].
علاوهبر ورزش، استفاده از گیاهان دارویی در پیشگیری از چاقی مطرح است [15]. ازجمله گیاه زنجبیل با نام علمی zingiber officinale است [1]. به نظر میرسد زنجبیل یکی از رایجترین ادویهها و مکملهای غذایی است که در مقابل چاقی و اختلالات مرتبط با آن اثرات مفیدی دارد [16]. مطالعه جینگ وانگ و همکاران نشان میدهد که تعدیل میکروبیوتایز روده بهعنوان یک نتیجه از مکمل زنجبیل تأثیر درمانی بر چاقی موشها دارد [15]. جینجرول یکی از ترکیبات مهم و فعال زنجبیل است که دارای اثرات کاهندگی چاقی با تغییر در فعالیت و بیان برخی از آنزیمهای دخیل در متابولیسم مواد مغذی است [16]. باتوجهبه پژوهشهای انجامشده، نشان داده شده است شدت و نوع تمرین از اصلیترین عوامل تأثیرگذار بر سطوح آیریزین است و شدتهای بالای تمرینی، سبب افزایش بیشتر سطوح سرمی آیریزین میشود [17، 18]. پژوهشی به مقایسه دو شدت کم (40% VO2max) و زیاد (80% VO2max ) تمرینی بر سطوح آیریزین سرمی پرداخته است که نتایج آن حاکی از افزایش معنادار آیریزین در تمرین با شدت بالا بود [17]. ﻣﺸﺨﺺ ﺷﺪ زﻧﺠﺒﻴﻞ ﺑﺎ اﺛﺮ ﺑﺮ روی ﻛﺒﺪ ﺑﺎﻋﺚ ﻛﺎﻫﺶ ﺑﻴﻮﺳﻨﺘﺰ ﻛﻠﺴﺘﺮول میشود و اﺣﺘﻤﺎﻻً ﺗﺒﺪﻳﻞ ﻛﻠﺴﺘﺮول ﺑﻪ اﺳﻴﺪﻫﺎی ﺻﻔﺮاوی را ﺗﺤﺮﻳﻚ میکند و دﻓﻊ آن را اﻓﺰاﻳﺶ میدهد [19]. اﺛﺮ زﻧﺠﺒﻴﻞ در ﭘﺎﻳﻴﻦ آوردن ﺗﺮیﮔﻠﻴﺴﺮﻳﺪ ﺧﻮن ﻣﻤﻜﻦ اﺳﺖ هم ازﻃﺮﻳﻖ اﻓﺰاﻳﺶ ﻣﻴﺰان و هم ﻓﻌﺎﻟﻴﺖ ﻟﻴﭙﻮﭘﺮوﺗئین ﻟﻴﭙﺎز عروقی ﺑﺎﺷﺪ ﻛﻪ ﺑﺎﻋﺚ میشود ﺗﺮیﮔﻠﻴﺴﺮﻳﺪهای ﻣﻮﺟﻮد در ﻋﺮوق ﺧﻮنی ﺗﺠﺰﻳﻪ شود و ﺳﺒﺐ ﻛاهش ﺗﺮیﮔﻠﻴﺴﺮﻳﺪها در ﭘﻼﺳﻤﺎ ﮔﺮدد. ﺑﺎ ﻛﺎهش ﺗﺮیﮔﻠﻴﺴﺮﻳﺪ ﺗﻮﺳﻂ زﻧﺠﺒﻴﻞ، ﻣﻴﺰان لیپوپروتیین کم چگال ﻧﻴﺰ بهطور معناداری کم میشود [21].
بهدلیل نبود پژوهش دررابطهبا تأثیر نوع انقباضات عضلانی ناشی از تمرینات برونگرا و درونگرا بر سطح آیریزین سرم و تأثیر این نوع تمرین بر آیریزین و مقاومت به انسولین همراه با مصرف مکمل، لذا پزوهش حاضر با هدف بررسی تأثیر 4 هفته مصرف مکمل زنجبیل بر هورمون آیریزین، انسولین، شاخص مقومت انسولین و نیمرخ لیپیدی دختران چاق به دنبال فعالیت حاد برونگرا و درونگرا انجام شد.
مواد و روش ها
پروتکل ورزشی
این پژوهش به روش نیمهتجربی از نوع کاربردی است که جامعه آماری این تحقیق را دختران چاق تشکیل میدادند. ﭘﺲ از اﻋﻼم ﻓﺮاﺧﻮان، 100 ﻧﻔﺮ ﻣﺮاﺟﻌﻪ کردند ﮐﻪ از ایﻦ ﺗﻌﺪاد،50 نفر ﮐﻪ ﻣﻌﯿﺎرهای ﻻزم را دارا ﺑﻮدﻧﺪ، ﺑﻪ روش ﻧﻤﻮﻧﻪﮔﯿﺮی هدفمند و دردﺳﺘﺮس اﻧﺘﺨﺎب ﺷﺪﻧﺪ. ﻋﺪم وﺟﻮد ﺳﺎﺑﻘﻪ ﺑﯿﻤﺎری ﺧﺎص، عدم استفاده از داروها، عدم فعالیت بدنی، ≥30شاخص توده بدن کیلوگرم بر مترمربع، دامنه سنی 23-25 سال، بهعنوان معیار ورود در نظر گرفته شد. ﻣﻌﯿﺎرﻫﺎی ﺧﺮوج از ﭘﮋوهش ﻧﯿﺰ رﻋﺎیﺖ ﻧﮑﺮدن ﺗﻮﺻﯿﻪهای ﻣﺤﻘﻘﯿﻦ و ﻋﺪم ﺣﻀﻮر ﻣﺮﺗّﺐ در ﺗﻤﺮیﻨﺎت یﺎ ﻣﺼﺮف مواد دارویی در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﺷﺪ ﮐﻪ هیچ ﮐﺪام از اﻓﺮاد ﺑﻪ ایﻦ دﻟﯿﻞ ﺣﺬف ﻧﺸﺪﻧﺪ. تمامی افراد سالم بودند و طبق نظر پزشک عمومی منعی برای شرکت در فعالیت نداشتند. آزمودنیها یک هفته قبل از شروع آزمون، آزمون برونگرا و درونگرا را برای آشنایی با نحوه اجرای آن، انجام دادند. آزمودنیها بعد از آشنایی با نحوه انجام تمرینات و تکمیل فرم رضایتنامه شرکت در تحقیق، قد، وزن و همچنین ترکیب بدن و درصد چربی بدن آنها بهوسیله دستگاه بیوامپدانس الکتریکی (مدل3/3،Olympia، ساخت کرهجنوبی) اندازهگیری و حداکثر اکسیژن مصرفی آنها ازطریق آزمون بالک بر روی تردمیل محاسبه و افراد ازنظر توان هوازی همگن شدند [23]. ﭘﺲ از ﻏﺮﺑﺎﻟﮕﺮی و اﻧﺘﺨﺎب ﻧﻤﻮﻧﻪهای پژوهش، شرکتکنندگان بهطور تصادفی ساده در 5 گروه شامل: برونگرا (10=تعداد)، درونگرا (10=تعداد)، برونگرا+مکمل (10=تعداد)، درونگرا+مکمل (10=تعداد) و کنترل (دارونما) (10=تعداد) تقسیم شدند. فعالیت ورزشی این پژوهش شامل دو جلسه فعالیت برونگرا و درونگرا واماندهساز بر روی تردمیل بود.
آزمودنهای گروههای برونگرا+مکمل و درونگرا+مکمل، روزاﻧﻪ ﻳﻚ ﮔﺮم ﻛﭙﺴﻮل زﻧﺠﺒﻴﻞ (زﻳﻨﺘﻮﻣﺎ) را در دُزهای250 میلیﮔﺮمی، 2 وﻋﺪه در روز (قبل از نهار و شام) ﺑﻪ 4 هفته دریافت کردند. ﮐﭙﺴـﻮلﻫای زﻧﺠﯿﺒـﻞ (زیﻨﺘﻮﻣـﺎ) از ﺷﺮﮐﺖ ﻓﺮاوردههای داروﺋﯽ ﮔﯿﺎﻫﯽ ﮔﻞ دارو ﺑﺎ ﻣﺠﻮز ﺑﻬﺪاﺷﺘﯽ 1228022777.IRC از اداره ﮐﻞ ﻧﻈﺎرت ﺑﺮ ﻣـﻮاد ﻏـﺬایﯽ وزارت ﺑﻬﺪاﺷﺖ و درمان آموزش پزشکی ﺗﻬﯿﻪ ﺷﺪ. گروه دارونما طی این 4 هفته از کپسول حاوی نشاسته (دارونما) استفاده کردند. تمامی گروههای مکمل و دارونما طی این 4 هفته مکملگیری هیچگونه فعالیت ورزشی نداشتند و پس از پایان 4 هفته مکملگیری، آزمودنیها فعالیت حاد تک جلسهای درونگرا و برونگرا را انجام دادند. آزمودنیهای پژوهش با استفاده از تردمیل(Cosmuse/hp، مدل Saturn، ساخت کشور آلمان) تمرین برونگرا و درونگرا را با استفاده از پروتکل الستد طبق جدول شماره 1 تا حد خستگی و واماندگی انجام میدادند [23].
.jpg)
آزمودنیهای گروه برونگرا پشت به صفحه تردمیل و آزمودنیهای گروه درون گرا رو به صفحه تردمیل میدویدند. تمرین بین ساعت7:30 تا9:30 صبح انجام شد. ضربان قلب بیشینه افراد در حالت استراحت و قبل از تمرین براساس معادله کارونن (سنHRmax=220-) محاسبه و درطول تمرین با استفاده از ضربان سنج (مدل پولار ساخت کشور فنلاند) که در ناحیه سینه آزمودنیها نصب و بر روی صفحه نمایش دستگاه تردمیل مشاهده میشد، کنترل میشد. دارا بودن حداقل 2 شرط از 3 شرط توقف تمرین (اظهار ناتوانی فرد جهت ادامه فعالیت و نمره آزمون بالای 16 از مقیاس درک فشار بورک و ضربان قلب بالاتر از (HRmax) به منزله پایان تست آزمودنی تلقی میشد.
آزمودنیهای هر 2 گروه قبل از شروع تمرین به مدت 5 دقیقه گرم میکردند. برای جلوگیری از تأثیر نوع غذای مصرفی بر نتایج تحقیق، تمام وعدههای غذایی روز قبل از آزمون بهصورت یکسان بین همه آزمودنی ها توزیع شد و همچنین جهت جلوگیری از تأثیر احساس سقوط افراد از روی تردمیل بر زمان و میزان خستگیِ ناشی از تمرین، از جلیقه محافظی که به تردمیل متصل و به بالاتنه آزمودنی وصل بود، استفاده میشد و با کوچکترین انحراف فرد از مسیر مستقیم، تردمیل را متوقف میکرد.
نمونهگیری خونی و تحلیل آن
خونگیری از آزمودنیها طی 2 مرحله و هر مرحله 5 سیسی از ورید بازویی گرفته شد. مرحله اول آن پیش از انجام فعالیت بدنی و مرحله بعدی بلافاصله بعد از فعالیت بدنی انجام شد. نمونههای خونی در حالت ناشتا در پیشآزمون و پسآزمون تهیه شدند و بعد از جمعآوری در آزمایشگاه با 3500 دور در دقیقه سانتریفیوژ شدند. و تا انجام کار نمونهها در دمای20- سانتیگراد قرار گرفتند. در این پژوهش اندازهگیری سطوح آیریزین سرم بهروش ساندویچ الایزا (با استفاده از کیت با برچسب CUSABIO ساخت کشور ژاپن)، سطح انسولین به روش الایزا (با استفاده ازکیت مونوبایند ساخت کشور آمریکا) و سطح گلوکز سرم (بهوسیله کیت شرکت پارس آزمون ساخت ایران) بهروش گلوکز اکسیداز انجام شد. سطوح تریگلیسرید، لیپوپروتئین با چگالی پایین، لیپوپروتئین با چگالی بالاو کلسترول تامبهروش آﻧﺰیﻤﺎﺗﯿﮏ و ﮐﯿﺖ ﺷﺮﮐﺖ ﭘﺎرس و دستگاه اتوآنالایزر بیوشیمی آزﻣﻮن اﻧﺪازهﮔﯿﺮی شد. شاخص مقاومت به انسولین HOMA-IR نیز ازطریق فرمول شماره 1 به دست آمد [24].
1.
HOMA-IR = گلوکز ناشتا (mmol/L)×انسولین ناشتا (µIU/ml)÷22/5
روش آماری
ازآمار توصیفی برای محاسبه میانگین از آزمون شاپیرو-ویلک برای تعیین توزیع طبیعی دادهها استفاده شد. از آزمون تی وابسته برای مقایسه تغییرات متغیرها قبل و بعد از تمرین و همچنین از آزمون تحلیل واریانس یکطرفه برای بررسی تغییرات بین تمرینها و همچنین برای بررسی ارتباط بین متغیرها از آزمون همبستگی پیرسون استفاده شد. با استفاده از نسخه 23 نرمافزار SPSS تمامی محاسبات تجزیهوتحلیل شدند و سطح معناداری آزمونها 0/05>P در نظر گرفته شد.
یافتهها
میانگین و انحرافمعیار شاخصهای آنتروپومتریکی (پیکرسنجی)، ترکیب بدنی و فیزیولوژیکی (vo2max)، میانگین زمان درماندگی و ضربان قلب تمرین آزمودنیهای مورد مطالعه در جدول شماره 2 نشان داده شده است.
.jpg)
نتایج آزمون آماری مربوط به آیریزین، انسولین، شاخص مقاومت انسولین و نیمرخ لیپیدی در جدول شماره 3 ارائه شده است.
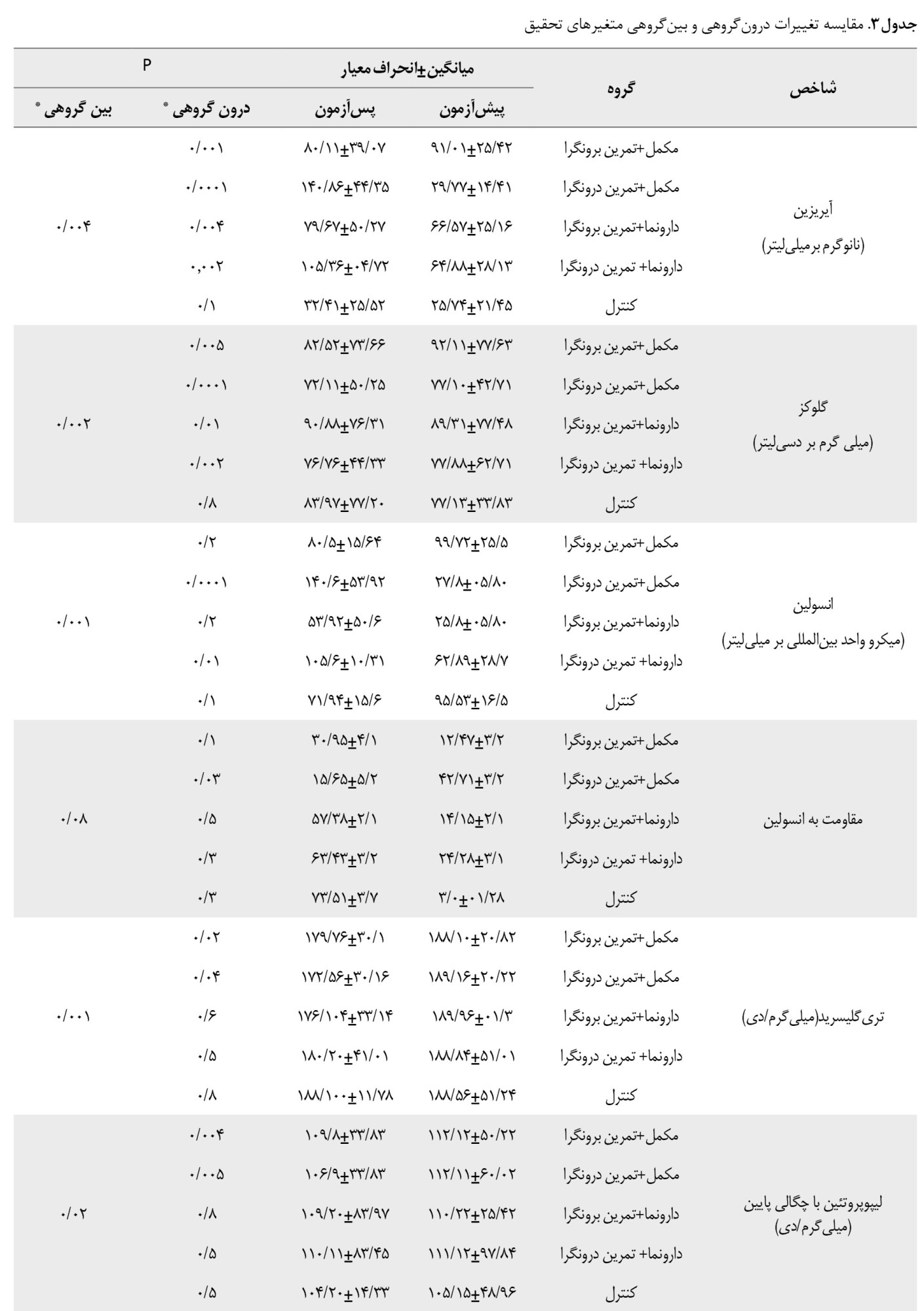

باتوجهبه نتایج آزمون آماری بر روی آیریزین، مشخص شد که میزان این هورمون بین 2 نوع فعالیت برونگرا و درونگرا پس از 4 هفته مصرف مکمل زنجبیل در گروههای مکمل و تمرین افزایش معناداری یافته است (0/04=P). نتایج نشان داد تغییرات گلوکز (0/002=P) و انسولین (0/001=P) بین همه گروهها پس از 4 هفته مصرف مکمل زنجبیل بهترتیب کاهش و افزایش معنادار یافته است. همچنین مشخص شد تغییرات شاخص مقاومت به انسولین پس از 4 هفته مصرف مکمل زنجبیل بین همه گروهها کاهش جزیی و غیر معنادار است (0/08=P). نتایج آزمون همبستگی سطوح آیریزین با متغیرهای تحقیق در 2 نوع تمرین حاد برونگرا و درونگرا در جدول شماره 4 نشان داده شده است.
.jpg)
نتایج نشان داد بین سطوح آیریزین با انسولین و مقاومت به انسولین در تمرین درونگرا ارتباط مثبت معناداری وجود داشت (0/05>P)، درحالیکه در تمرین برونگرا بین سطوح آیریزین، گلوکز، انسولین و شاخص مقاومت به انسولین ارتباط معناداری مشاهده نشد. نتایج آماری نشان داد سطوح تریگلیسرید، کلسترول تام و لیپوپروتئین با چگالی پایین بین همه گروهها پس از 4 هفته مصرف مکمل زنجبیل بهترتیب کاهش معناداری یافته است (0/04=P)، (0/001=P)، (0/02=P). علاوهبراین براساس نتایج تحلیل واریانس یکطرفه لیپوپروتئین با چگالی بالا در بین همه گروهها پس از 4 هفته مصرف مکمل زنجبیل افزایش غیر معناداری یافته است (0/07=P).
بحث
براساس نتایج تحلیل واریانس یکطرفه این تحقیق 4 هفته مصرف مکمل زنجبیل بهدنبال فعالیت حاد برونگرا و درونگرا در گروه مکمل نسبت به گروه دارونما بر سطوح آیریزین سرم و انسولین افزایش معنادار و برگلوکز کاهش معنادار را نشان داد. همچنین 4 هفته مصرف مکمل زنجبیل بهدنبال فعالیت حاد برونگرا و درونگرا در گروه مکمل نسبت به گروه دارونما در سطوح کلسترول تام، تریگلیسرید ولیپوپروتئین با چگالی پایین در سطح معنا داری بود، اما در سطوح لیپوپروتئین با چگالی بالا معناداری نبود. ازجمله سازوکارهای احتمالی مطرحشده در مورد تأثیر احتمالی زنجبیل بر شاخصهای تنسنجی میتوان به افزایش گرمازایی و مصرف انرژی ازطریق آزادسازی کاتکولامینها، تجزیه سلولهای چربی در بافت چربی سفید و مهار آنزیم لیپاز لومن روده و درنتیجه کاهش چربی دریافتی اشاره کرد [25، 26]. زنجبیل میتواند چاقی را از طریق مکانیسمهای مختلف بالقوه ازجمله افزایش ترموژنز، افزایش لیپولیز، سرکوب لیپوژنز، مهار جذب چربی روده و کنترل اشتها تعدیل کند [26]. درخصوص اثر تمرینات ورزشی بر شاخصهای تنسنجی نیز برخی مطالعات انجامشده نشان دادهاند که انواع تمرینات هوازی و بیهوازی موجب کاهش محسوس در شاخصهای تنسنجی میشود [27].
آیریزین یک مایوکاین است که بهوسیله فعالیت ورزشی حاد تحریک شده و هزینه انرژی را افزایش داده است. درنتیجه نقش مهمی در چاقی و اختلالات متابولیکی دارد و بهعنوان یک هدف درمانی بالقوه در آینده میباشد [11]. بااینحال فیزیولوژی آن در انسان تا حد زیادی ناشناخته باقی مانده است. نتایج این پژوهش نشان داد آیریزین و مقاومت به انسولین افراد بعد از هر 2 نوع تمرین افزایش یافته است که بین 2 نوع تمرین ازنظر میزان آیریزین تفاوت معنا دار بوده، اما ازنظر افزایش مقاومت به انسولین تفاوت معناداری وجود نداشته است. یافتههای این پژوهش با نتایج مطالعات تسوچیا وهمکاران [9] و بوستروم و همکاران [7] همسو و با و هکستدن و همکاران [28] ناهمسو است. انقباضات عضله طی تمرین، یکی از دلایل افزایش ترشح آیریزین پس از تمرین در موش و انسان بیان شده است [7]. تسوچیا و همکاران سطح سرمی آیریزین را بر روی تردمیل در 2 شدت متفاوت 40 و 80 درصد vo2max اندازهگیری و به این نتیجه رسیدند که پاسخ آیریزین سرم به تمرین پرشدت بیشتر است که در راستای نتایج تحقیق حاضر است.
درمطالعه ای که اثر 1 جلسه فعالیت حاد و 8 هفته تمرین مزمن بر روی آیریزین 15 مرد جوان سالم تمرینکرده بررسی میشد، مشخص شد که در راستای کاهش ATP عضلانی و افزایش سوختوساز پس از فعالیت حاد، میزان آیریزین در گردش بهصورت معناداری افزایش یافته بود، اما میزان آیریزین در پاسخ به 8 هفته تمرین بدون تغییر بوده است. بنابراین باتوجهبه ارتباط بین غلظت آیریزین و تغییرات سوختوساز عضلانی در پاسخ به تمرین حاد میتوان چنین فرض کرد که بین آیریزین در گردش و ATP ارتباط وجود دارد و ممکن است یکی از دلایل تغییرنکردن آیریزین بعد از 8 هفته، عدم تغییر در ATP عضلانی باشد [18]. هکستدن و همکاران با بررسی 26 هفته تمرین ایروبیک با60 درصد ضربان قلب و تمرین استقامت عضلانی در افراد جوان به این نتیجه رسیدند که تفاوتی بین گروهها ازنظر میزان آیریزین وجود ندارد که تخریب آیریزین ناشی از طولانی بودن دوره انجماد نمونههای سرم را بهعنوان عامل اصلی اثرگذار بر نتیجه پژوهش خود بیان کرده است [28].
نتایج پژوهش یلدشده ناهمسو با نتایج پژوهش حاضر است. از علت ناهمسویی میتوان نوع آزمودنی یا شدت تمرین بیان کرد. برخی پژوهشگران معتقدند که اوج تغییرات آیریزین یک ساعت پس ازتمرین بوده که با گذشت زمان، مقادیرآن به سطح پایه برمیگردد [9]. برهمین اساس در پژوهش حاضر مشابه مطالعات دیگر [9، 30] نمونهگیری خونی بلافاصله پس از تمرین حاد انجام شد که شاید یکی از دلایل توجیهکننده افزایش آیریزین در مطالعه حاضر باشد. ازجمله دلایل عدم تغییر آیریزین را میتوان طولانیتر بودن دوره تمرینات دانست که منجر به سازگاری در افزایش آیریزین شده و احتمالاً شدت جلسات تمرینی جهت تحریک آیریزین ناکافی بوده است که با نتایج پژوهش حاضر متناقض میباشند. تفاوت کیتهای تجاری در مطالعات مختلف را نیز میتوان ازجمله عوامل نتایج مغایر با تحقیق حاضر دانست [31]. در برخی مطالعات نشان داده شده است که زنجبیل و مواد فعال موجود در آن بهویژه جینجرول میتواند موجب افزایش PGC-1 شود و از این نظر ممکن است بر سطوح آیریزین سرم مؤثر باشد [31]. در ارتباط با اثر تمرینات ورزشی در یک مطالعه، 8 هفته تمرینات تناوبی در زنان چاق، تغییر معناداری در آیریزین سرم ایجاد نکرد [32].
فعالیت زنجبیل را میتوان با تسریع در متابولیسم لیپیدها ازطریق مدولاسیون در بیان آنزیمهای مارکر [32] و مهار آن از میزان بیان پروتئین رتینوئید اتصالدهنده (RBP)mRNA در کبد و چربی احشایی که مربوط به متابولیسم لیپید است، نسبت داد. ژن و شاخص مهمی از هایپرلیپیدمی [32]. در همین حال ، زنجبیل با تنظیم بیان پروتئین اتصالدهنده عنصر پاسخ کربوهیدرات (ChREBP)، تبدیل کربوهیدراتهای اضافی به تریگلیسرید را مهار میکند [33]. علاوهبراین، اثر زنجبیل بر کاهش کلسترول سرم ممکن است بهدلیل اثر مهاری بیوسنتز کلسترول و تبدیل کلسترول به اسیدهای صفراوی با افزایش فعالیت کلسترول کبدی آلفا-هیدروکسیلاز باشد [32]. نیاسین، ماده مغذی موجود در زنجبیل [32] ، ممکن است یک ماده فعال بالقوه در کاهش سطح تری گلیسیرید سرم، افزایش ترشح VLDL ، افزایش جذب کبدی LDLc و مهار سنتز کلسترول باشد [33]. این نتایج با یافتههای پائولی، هواانلو و همکاران همسو بود [33 ،34].
بعضی تحقیقات نیز، از جمله المر و همکاران نشان داد 8 هفته اﺟﺮای تمرین تناوبی با شدت بالا، بر روی ﭘﺮوﻓﺎیﻞ ﻟﯿﭙﯿﺪی ﻣﺮدان ﺟﻮان ﺳﺎﻟﻢ ﺗﺄﺛﯿﺮ ﻣﻌﻨاداری ﻧﺪارد [35]. با وﺟﻮد ﻣﻄﺎﻟﻌﺎت بیانشده، المر گزارش کرد 8 هفته اﺟﺮای تمرین تناوبی شدید با شدت 80- درصد بیشینه اﮐﺴﯿﮋن ﻣﺼﺮﻓﯽ (3 ﺟﻠﺴﻪ در هفته)، ﺑﺮ ﭘﺮوﻓﺎیﻞ ﻟﯿﭙﯿﺪی 12 ﻣﺮد ﺟﻮان ﺳﺎﻟﻢ ﺗﺄﺛﯿﺮ ﻣﻌﻨاداری ﻧﺪاﺷﺖ. وی ﺷﺪت و ﻣﺪت ﺗﻤﺮیﻨﺎت را ﺑﺮ ایﻦ ﺷﺎﺧﺺها اﺛﺮﮔﺬار داﻧﺴﺖ [35]. دﻟﯿﻞ ناهمسویی یﺎﻓﺘﻪهای ﭘﮋوهش ﻓﻮق ﺑﺎ یﺎﻓﺘﻪهای پژوهش کنونی، پروتکل تمرینی و نوع آزمودنی بیان شد. پائولی و همکاران کاهش معنادار تریگلیسرید، لیپوپروتئین با چگالی پایین و کلسترول تام و افزایش لیپوپروتئین با چگالی بالا را ﭘﺲ از 12 هفته اﺟﺮای HIT با شدت 75 درصد ﺿﺮﺑﺎن ﻗﻠﺐ ذﺧﯿﺮه، ﮔﺰارش ﮐﺮدهاﻧﺪ [34].
هوانلو و همکاران در پژوهشی کاهش معنادار تریگلیسرید، لیپوپروتئین با چگالی پایین و کلسترول تام و افزایش لیپوپروتئین با چگالی بالا را در موشهای دیابتی، پس از 5 هفته تمرین هوازی بههمراه مصرف چای سبز ﮔﺰارش کردند [34]. دﻟﯿﻞ اﺣﺘﻤﺎﻟﯽ همسویی یافتههای دو پژوهش گفتهشده ﺑﺎ یﺎﻓﺘﻪهای پژوهش کنونی، شدت تمرین یا مصرف مکمل بیان شد. یافتههای پژوهش کنونی مبنی بر کاهش مقادیر تریگلیسرید، لیپوپروتئین با چگالی پایین و کلسترول تام و افزایش لیپوپروتئین با چگالی بالا با نتایج الرخ و همکاران همسو اﺳﺖ [36]. نوع ازمودنی یا نوع و شدت تمرین را علت همسویی برای پژوهشها یادشده میتوان بیان کرد.
مطالعات جی زو و همکاران نشان داد اثر مفید زنجبیل (یعنی کاهش قند خون ناشتا) ممکن است در بیماران مبتلا به هایپرگلیسمی برجستهتر از بدون هایپرگلیسمی باشد [37]. این یافته با مطالعات قبلی سازگار بود که نشان داد FBG بهطور قابلتوجهی کاهش یافته و عدم تحمل گلوکز پس از تجویز زنجبیل موشهای صحرایی دیابتی بهطور قابلتوجهی بهبود یافته است [38]. مکانیسم اساسی شامل مهار α-گلوکزیداز و α-آمیلاز است که آنزیمهای کلیدی در هضم و جذب کربوهیدراتهای پیچیده هستند [39]. علاوهبراین، 6-زنجبیل، یک جزء زنجبیل، فعالیت مهمی در تحریک متابولیسم گلوکز از طریق مسیر AS160-Rab5 با واسطه AMPKalpha2 و از طریق تقویت تنظیم گلوکز واسطه انسولین نشان داد [40].
6-پارادول و 6-شوگائول که ترکیبات تند زنجبیل هستند، تأثیرات یکسانی دارند [41]. زنجبیل همچنین میتواند بیانگر انتقالدهنده گلوکز نوع4 [35] را گلوکز نوع 4 را افزایش دهد تا جذب گلوکز را در سلولهای چربی و سلولهای عضلانی اسکلتی تقویت کند [42]. علاوهبراین، زنجبیل میتواند سطح انسولین ناشتا و HOMA-IR را کاهش دهد. حساسیت به انسولین را میتوان با تنظیم تنظیم آدیپونکتین و گیرنده فعالکننده پرولیفراتیو پراکسیزوم (γ (PPAR γ [36] و با تعامل سازنده زنجبیل با گیرنده 5-HT3 افزایش داد [42]. درعینحال 6-زنجبیل که از زنجبیل استخراج میشود، میتواند از سلولهای β پانکراس محافظت کند [43]. کاهش HbA1c بیشتر نشان میدهد که زنجبیل دارای اثر طولانی مدت در کاهش قند خون است.
یافتههای پژوهش حاضر نشان داد مقاومت به انسولین پس از یک جلسه تمرین برونگرا ودرونگرا افزایش جزیی پیدا کرده که با مطالعات قنبری نیاکی و همکاران [44] همخوان است. از دلایل همخوانی میتوان نوع و شدت تمرین بیان کرد. همچنین تغییرات انسولین و گلوکز میتواند موجب تغییر در مقاومت و حساسیت انسولینی بدن شود. بنابراین این احتمال وجود دارد که تمرین برونگرا و درونگرا تأثیری را بر بیان پروتئین گلوکز نوع4 نگذاشته است و ازطرفی چون باعث افزایش در انسولین و گلوکز سرم بعد از هر 2 نوع تمرین شد، بنابراین این تغییرات، افزایش مقاومت به انسولین را به همراه خواهد داشت. در تحقیق فیلیپ و همکاران مشخص شد که بعد از یک دوره 1ساعته تمرین درونگرا و یک دوره تمرین1ساعته بدون آسیب برونگرا با شدت 55%VO2max ، تغییرات گلوکز بهبود مییابد (1و 2ساعت بعد از تمرین درونگرا و 1ساعت بعد از تمرین برونگرا) که با یافتههای پژوهش ما ناهمسو است [45]. از جمله دلایل احتمالی تفاوت نتایج در پژوهش حاضر میتوان به آثار احتمالی خستگی و آسیب ناشی از تمرین شدید درونگرا و برونگرا بر مکانیسم گلوکز و شاخص مقاومت به انسولین و همچنین کوتاه بودن دوره انجام فعالیت و شدت بالای تمرینات در تحقیق حاضر، بهعنوان عوامل مؤثر بر عدم تأثیر در بهبود مقاومت به انسولین نام برد.
ترشح آیریزین در خون بهوسیله افزایش در بیان ژن پروتئین UCP1، باعث بهبود مقاومت به انسولین و درنهایت منجر به قهوهای شدن بافت چربی سفید میشود. PGC1-ɑ ترشح آیریزین را افزایش میدهد ودر بیوسنتز میتوکندریایی شرکت میکند و متابولیسم اکسیداتیو را بهبود میبخشد [7]. میتوکندری نقش مهمی را در مقاومت به انسولین ایفا میکند و کاهش در بیان یا عملکردPGC1-ɑ باعث ایجاد مقاومت به انسولین و دیابت میشود [46].
براساس یافتههای این پژوهش در تمرین برونگرا بین آیریزین سرم و شاخص مقاومت به انسولین ارتباط معناداری مشاهده نشد. شاید یکی از دلایل معنادار نبودن ارتباط را بتوان به تعداد کم نمونههای این مطالعه نسبت داد. ممکن است ناشتا بودن آزمودنیها در هردو مرحله از خونگیری و همچنین مدت کوتاه و شدت بالای تمرین دلیلی بر عدم بهبود مقادیر گلوکز، انسولین و مقاومت به انسولین باشد. تیمونز و همکاران در سال 2012، بهبود شاخص مقاومت انسولینی در اثر تمرین را تأیید و ارتباط بین آیریزین و مقاومت انسولین را رد کردند. بوستروم در جواب به تیمونز توضیح داد که روش سنجش متفاوت تمیونز را میتوان دلیلی برای وجود این اختلاف در پژوهش دانست [47].
همچنین در پژوهش حاضر مشخص شد بین سطوح سرمی آیریزین و شاخص مقاومت به انسولین در زنان چاق در تمرین درونگرا ارتباط مستقیم معناداری وجود دارد که علت این ارتباط را شاید بتوان به افزایش انسولین و نقش آیریزین در حفظ سیگنال انسولین دانست. با درنظر گرفتن تأثیر عواملی ازقبیل شدت و مدت تمرین و همچنین تأثیر احتمالی نوع انقباضات عضلانی حین تمرین، افزایش آیریزین در پژوهش حاضر قابل توجیه است که ممکن است هرکدام از این عوامل و شاید ناشتا بودن آزمودنیها در هر 2 مرحله از خونگیری باعث عدم بهبود مقاومت به انسولین در افراد چاق شده باشد.
عدم ارزیابی بیان ژن FNDC5 وPGC-1ɑ، یکسان نبودن مدت زمان و هزینه انرژی تمرین برای همه آزمودنیها و همچنین تفاوت افراد در پاسخ به خستگی و التهاب ناشی از تمرین و تأثیر احتمالی آنها بر ترشح آیریزین، بهعنوان محدودیتهای موجود در پژوهش حاضر میباشند.
نتیجه گیری
نتایج این پژوهش نشان داد ﻣﺼﺮف مکمل زﻧﺠﺒﻴﻞ به همراه دو نوع فعالیت برونگرا و درونگرا میﺗﻮاﻧﺪ تا حدودی ﺑﺮای کاهش گلوکزوﺗﻐﻴﻴﺮات ﻣﻄﻠﻮب در آیریزین، ﻣﻘﺎوﻣﺖ ﺑﻪ اﻧﺴﻮﻟﻴﻦ و نیمرخهای لیپیدی در زنان چاق مؤثر ﺑﺎﺷﺪ.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
کلیه شیوههای انجامشده در مطالعه در مورد شرکتکنندگان انسانی مطابق با معیارهای کمیته اخلاق همرا با کد اخلاق کد اخلاق IR.MEDILAM.REC.1395.192 است.
حامی مالی
این مقاله برگرفته از طرح پژوهشی مصوب دانشگاه لرستان است.
مشارکت نویسندگان
مفهومسازی، نگارش متن و بازبینی: اسما سلیمانی، محمد فتحی؛ روش پژوهش، نمونهگیری و تحلیل دادهها: اسما سلیمانی.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
چاقی مشکل اساسی در بهداشت عمومی و یک عامل زمینهایی در بسیاری از بیماری های مزمن و اختلالات مختلف میباشد [1 ,2]. طبق گزارش سازمان بهداشت جهانی در سال 2014، 39 درصد بزرگسالان دارای اضافه وزن و 13 درصد آنان چاق بودند [3]. منظور از چاقی حالتی است که در آن، بدن شخص دارای چربی بیش از اندازه باشد. در سالهای اخیر، تعامل بین بافتهای چربی و عضله بهطور فزایندهای شناسایی شده است که مربوط به ادیپوکینهای مترشحه از عضلات است که نقش مهمی در تنظیم وزن و چاقی دارند [4]. فعالیت بدنی باعث تحریک تولید مایوکینها میشود که دارای عملکرد مختلفی در عضلات اسکلتی، بافت چربی و رگهای خونی هستند [5, 6].
آیریزین یک مایوکاین جدید و محصول ژن FNDS است که بهطور عمده در عضلات تولید و توسط ژن PGC-1 تنظیم میشود و بهعنوان فاکتور میانجی اثرات مفید تمرینات ورزشی بر متابولیسم شناخته میشود که دارای خودتنظیمی مثبت میباشد [7]. همچنین آیریزین میتواند با بهبود متابولیسم لیپید و گلوکز و افزایش مصرف انرژی، موجب کاهش وزن شود [8]. اگرچه فعالیت ورزشی منظم بهواسطه افزایش هزینه انرژی، تسریع و بهبود اکسیداسیون چربیها، باعث کاهش عوامل خطرزای بسیاری از بیماریها میشود، اما مکانیسم دقیق افزایش هزینه انرژی ناشی از ورزش، همچنان نامشخص است [9]. تغییر فنوتیپ بافت چربی بر اثر تمرین تئوری جدیدی است که بهتازگی مطرح شده است، اما سازوکار سلولی مولکولی آن در حال بررسی است. بافت چربی به دو صورت بافت چربی سفید و بافت چربی قهوهای مشخص شده است. بافت چربی سفید بهعنوان مسئول اصلی ذخیرهسازی چربی و انرژی و بافت چربی قهوهای بهدلیل تنفس خارجی میتوکندری میتواند انرژی را بهصورت گرما انتقال دهد [10].
در مطالعه بوستروم و همکاران مشخص شد که فعالیت بدنی با افزایش بیان ژن PGC1a در عضله، باعث افزایش پروتئین غشایی FNDC5 و درنهایت ترشح هورمونی بنام آیریزین میشود. آیریزین بهعنوان یک مایوکاین عمل میکند و با افزایش بیان ژن پروتئین UCP1 در میتوکندریهای سلولهای چربی موجب تبدیل بافتهای چربی سفید به قهوهای میشود. درنتیجه با افزایش فرایند گرمازایی باعث بهبود تحمل گلوکز، افزایش حساسیت به انسولین، کاهش در وزن بدن و کاهش توده چربی در موشها میشود [7] بااینحال، تناقضات در مورد ارتباط آیریزین در انسان بهویژه در پیشگیری و درمان چاقی وجود دارد. برخی از مطالعات انسانی گزارش کردهاند که یک همبستگی مثبت بین سطوح پایه در گردش آیریزین یا بیان FNDC5 mRNA و شاخص توده بدن وجود دارد [7]. درحالیکه مطالعات دیگر یک ارتباط منفی بین آیریزین در گردش با شاخص توده بدن یافتند [7].
هرچند اطلاعات مطالعات انسانی محدود هستند، اما مشخص شد ورزش باعث افزایش قابل توجهی در غلظت آیریزین میشود [7]. اخیراً مشخص شد تمرین برونگرا و درونگرا بر روی تردمیل اثرات مشابهی در بهبود متابولیسم گلوکز و چربیها در افراد سالم غیرفعال دارد [11]. افراد غیرفعال گروههایی هستند که هیچگونه فعالیت ورزشی ندارند. اگرچه آنها با استفاده از پروتکلهای مختلف مشخص کردند که تمرین با شیب منفی ازطریق افزایش سیگنالینگ و بهبود عمل انسولین باعث تعدیل مثبت مقاومت به انسولین و تحمل گلوکز در زنان و مردان میشود [12]، درحالیکه یک جلسه تمرین استقامتی درونگرا بهطور کلی با بهبود فعالیت انسولین و انتقال گلوکز همراه است [13]. بسیاری از مطالعات نشان میدهند که آسیب عضلانی ناشی از تمرین غیرعادی برونگرا ممکن است اثرات منفی بر متابولیسم گلوکز بگذارد [14].
علاوهبر ورزش، استفاده از گیاهان دارویی در پیشگیری از چاقی مطرح است [15]. ازجمله گیاه زنجبیل با نام علمی zingiber officinale است [1]. به نظر میرسد زنجبیل یکی از رایجترین ادویهها و مکملهای غذایی است که در مقابل چاقی و اختلالات مرتبط با آن اثرات مفیدی دارد [16]. مطالعه جینگ وانگ و همکاران نشان میدهد که تعدیل میکروبیوتایز روده بهعنوان یک نتیجه از مکمل زنجبیل تأثیر درمانی بر چاقی موشها دارد [15]. جینجرول یکی از ترکیبات مهم و فعال زنجبیل است که دارای اثرات کاهندگی چاقی با تغییر در فعالیت و بیان برخی از آنزیمهای دخیل در متابولیسم مواد مغذی است [16]. باتوجهبه پژوهشهای انجامشده، نشان داده شده است شدت و نوع تمرین از اصلیترین عوامل تأثیرگذار بر سطوح آیریزین است و شدتهای بالای تمرینی، سبب افزایش بیشتر سطوح سرمی آیریزین میشود [17، 18]. پژوهشی به مقایسه دو شدت کم (40% VO2max) و زیاد (80% VO2max ) تمرینی بر سطوح آیریزین سرمی پرداخته است که نتایج آن حاکی از افزایش معنادار آیریزین در تمرین با شدت بالا بود [17]. ﻣﺸﺨﺺ ﺷﺪ زﻧﺠﺒﻴﻞ ﺑﺎ اﺛﺮ ﺑﺮ روی ﻛﺒﺪ ﺑﺎﻋﺚ ﻛﺎﻫﺶ ﺑﻴﻮﺳﻨﺘﺰ ﻛﻠﺴﺘﺮول میشود و اﺣﺘﻤﺎﻻً ﺗﺒﺪﻳﻞ ﻛﻠﺴﺘﺮول ﺑﻪ اﺳﻴﺪﻫﺎی ﺻﻔﺮاوی را ﺗﺤﺮﻳﻚ میکند و دﻓﻊ آن را اﻓﺰاﻳﺶ میدهد [19]. اﺛﺮ زﻧﺠﺒﻴﻞ در ﭘﺎﻳﻴﻦ آوردن ﺗﺮیﮔﻠﻴﺴﺮﻳﺪ ﺧﻮن ﻣﻤﻜﻦ اﺳﺖ هم ازﻃﺮﻳﻖ اﻓﺰاﻳﺶ ﻣﻴﺰان و هم ﻓﻌﺎﻟﻴﺖ ﻟﻴﭙﻮﭘﺮوﺗئین ﻟﻴﭙﺎز عروقی ﺑﺎﺷﺪ ﻛﻪ ﺑﺎﻋﺚ میشود ﺗﺮیﮔﻠﻴﺴﺮﻳﺪهای ﻣﻮﺟﻮد در ﻋﺮوق ﺧﻮنی ﺗﺠﺰﻳﻪ شود و ﺳﺒﺐ ﻛاهش ﺗﺮیﮔﻠﻴﺴﺮﻳﺪها در ﭘﻼﺳﻤﺎ ﮔﺮدد. ﺑﺎ ﻛﺎهش ﺗﺮیﮔﻠﻴﺴﺮﻳﺪ ﺗﻮﺳﻂ زﻧﺠﺒﻴﻞ، ﻣﻴﺰان لیپوپروتیین کم چگال ﻧﻴﺰ بهطور معناداری کم میشود [21].
بهدلیل نبود پژوهش دررابطهبا تأثیر نوع انقباضات عضلانی ناشی از تمرینات برونگرا و درونگرا بر سطح آیریزین سرم و تأثیر این نوع تمرین بر آیریزین و مقاومت به انسولین همراه با مصرف مکمل، لذا پزوهش حاضر با هدف بررسی تأثیر 4 هفته مصرف مکمل زنجبیل بر هورمون آیریزین، انسولین، شاخص مقومت انسولین و نیمرخ لیپیدی دختران چاق به دنبال فعالیت حاد برونگرا و درونگرا انجام شد.
مواد و روش ها
پروتکل ورزشی
این پژوهش به روش نیمهتجربی از نوع کاربردی است که جامعه آماری این تحقیق را دختران چاق تشکیل میدادند. ﭘﺲ از اﻋﻼم ﻓﺮاﺧﻮان، 100 ﻧﻔﺮ ﻣﺮاﺟﻌﻪ کردند ﮐﻪ از ایﻦ ﺗﻌﺪاد،50 نفر ﮐﻪ ﻣﻌﯿﺎرهای ﻻزم را دارا ﺑﻮدﻧﺪ، ﺑﻪ روش ﻧﻤﻮﻧﻪﮔﯿﺮی هدفمند و دردﺳﺘﺮس اﻧﺘﺨﺎب ﺷﺪﻧﺪ. ﻋﺪم وﺟﻮد ﺳﺎﺑﻘﻪ ﺑﯿﻤﺎری ﺧﺎص، عدم استفاده از داروها، عدم فعالیت بدنی، ≥30شاخص توده بدن کیلوگرم بر مترمربع، دامنه سنی 23-25 سال، بهعنوان معیار ورود در نظر گرفته شد. ﻣﻌﯿﺎرﻫﺎی ﺧﺮوج از ﭘﮋوهش ﻧﯿﺰ رﻋﺎیﺖ ﻧﮑﺮدن ﺗﻮﺻﯿﻪهای ﻣﺤﻘﻘﯿﻦ و ﻋﺪم ﺣﻀﻮر ﻣﺮﺗّﺐ در ﺗﻤﺮیﻨﺎت یﺎ ﻣﺼﺮف مواد دارویی در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﺷﺪ ﮐﻪ هیچ ﮐﺪام از اﻓﺮاد ﺑﻪ ایﻦ دﻟﯿﻞ ﺣﺬف ﻧﺸﺪﻧﺪ. تمامی افراد سالم بودند و طبق نظر پزشک عمومی منعی برای شرکت در فعالیت نداشتند. آزمودنیها یک هفته قبل از شروع آزمون، آزمون برونگرا و درونگرا را برای آشنایی با نحوه اجرای آن، انجام دادند. آزمودنیها بعد از آشنایی با نحوه انجام تمرینات و تکمیل فرم رضایتنامه شرکت در تحقیق، قد، وزن و همچنین ترکیب بدن و درصد چربی بدن آنها بهوسیله دستگاه بیوامپدانس الکتریکی (مدل3/3،Olympia، ساخت کرهجنوبی) اندازهگیری و حداکثر اکسیژن مصرفی آنها ازطریق آزمون بالک بر روی تردمیل محاسبه و افراد ازنظر توان هوازی همگن شدند [23]. ﭘﺲ از ﻏﺮﺑﺎﻟﮕﺮی و اﻧﺘﺨﺎب ﻧﻤﻮﻧﻪهای پژوهش، شرکتکنندگان بهطور تصادفی ساده در 5 گروه شامل: برونگرا (10=تعداد)، درونگرا (10=تعداد)، برونگرا+مکمل (10=تعداد)، درونگرا+مکمل (10=تعداد) و کنترل (دارونما) (10=تعداد) تقسیم شدند. فعالیت ورزشی این پژوهش شامل دو جلسه فعالیت برونگرا و درونگرا واماندهساز بر روی تردمیل بود.
آزمودنهای گروههای برونگرا+مکمل و درونگرا+مکمل، روزاﻧﻪ ﻳﻚ ﮔﺮم ﻛﭙﺴﻮل زﻧﺠﺒﻴﻞ (زﻳﻨﺘﻮﻣﺎ) را در دُزهای250 میلیﮔﺮمی، 2 وﻋﺪه در روز (قبل از نهار و شام) ﺑﻪ 4 هفته دریافت کردند. ﮐﭙﺴـﻮلﻫای زﻧﺠﯿﺒـﻞ (زیﻨﺘﻮﻣـﺎ) از ﺷﺮﮐﺖ ﻓﺮاوردههای داروﺋﯽ ﮔﯿﺎﻫﯽ ﮔﻞ دارو ﺑﺎ ﻣﺠﻮز ﺑﻬﺪاﺷﺘﯽ 1228022777.IRC از اداره ﮐﻞ ﻧﻈﺎرت ﺑﺮ ﻣـﻮاد ﻏـﺬایﯽ وزارت ﺑﻬﺪاﺷﺖ و درمان آموزش پزشکی ﺗﻬﯿﻪ ﺷﺪ. گروه دارونما طی این 4 هفته از کپسول حاوی نشاسته (دارونما) استفاده کردند. تمامی گروههای مکمل و دارونما طی این 4 هفته مکملگیری هیچگونه فعالیت ورزشی نداشتند و پس از پایان 4 هفته مکملگیری، آزمودنیها فعالیت حاد تک جلسهای درونگرا و برونگرا را انجام دادند. آزمودنیهای پژوهش با استفاده از تردمیل(Cosmuse/hp، مدل Saturn، ساخت کشور آلمان) تمرین برونگرا و درونگرا را با استفاده از پروتکل الستد طبق جدول شماره 1 تا حد خستگی و واماندگی انجام میدادند [23].
.jpg)
آزمودنیهای گروه برونگرا پشت به صفحه تردمیل و آزمودنیهای گروه درون گرا رو به صفحه تردمیل میدویدند. تمرین بین ساعت7:30 تا9:30 صبح انجام شد. ضربان قلب بیشینه افراد در حالت استراحت و قبل از تمرین براساس معادله کارونن (سنHRmax=220-) محاسبه و درطول تمرین با استفاده از ضربان سنج (مدل پولار ساخت کشور فنلاند) که در ناحیه سینه آزمودنیها نصب و بر روی صفحه نمایش دستگاه تردمیل مشاهده میشد، کنترل میشد. دارا بودن حداقل 2 شرط از 3 شرط توقف تمرین (اظهار ناتوانی فرد جهت ادامه فعالیت و نمره آزمون بالای 16 از مقیاس درک فشار بورک و ضربان قلب بالاتر از (HRmax) به منزله پایان تست آزمودنی تلقی میشد.
آزمودنیهای هر 2 گروه قبل از شروع تمرین به مدت 5 دقیقه گرم میکردند. برای جلوگیری از تأثیر نوع غذای مصرفی بر نتایج تحقیق، تمام وعدههای غذایی روز قبل از آزمون بهصورت یکسان بین همه آزمودنی ها توزیع شد و همچنین جهت جلوگیری از تأثیر احساس سقوط افراد از روی تردمیل بر زمان و میزان خستگیِ ناشی از تمرین، از جلیقه محافظی که به تردمیل متصل و به بالاتنه آزمودنی وصل بود، استفاده میشد و با کوچکترین انحراف فرد از مسیر مستقیم، تردمیل را متوقف میکرد.
نمونهگیری خونی و تحلیل آن
خونگیری از آزمودنیها طی 2 مرحله و هر مرحله 5 سیسی از ورید بازویی گرفته شد. مرحله اول آن پیش از انجام فعالیت بدنی و مرحله بعدی بلافاصله بعد از فعالیت بدنی انجام شد. نمونههای خونی در حالت ناشتا در پیشآزمون و پسآزمون تهیه شدند و بعد از جمعآوری در آزمایشگاه با 3500 دور در دقیقه سانتریفیوژ شدند. و تا انجام کار نمونهها در دمای20- سانتیگراد قرار گرفتند. در این پژوهش اندازهگیری سطوح آیریزین سرم بهروش ساندویچ الایزا (با استفاده از کیت با برچسب CUSABIO ساخت کشور ژاپن)، سطح انسولین به روش الایزا (با استفاده ازکیت مونوبایند ساخت کشور آمریکا) و سطح گلوکز سرم (بهوسیله کیت شرکت پارس آزمون ساخت ایران) بهروش گلوکز اکسیداز انجام شد. سطوح تریگلیسرید، لیپوپروتئین با چگالی پایین، لیپوپروتئین با چگالی بالاو کلسترول تامبهروش آﻧﺰیﻤﺎﺗﯿﮏ و ﮐﯿﺖ ﺷﺮﮐﺖ ﭘﺎرس و دستگاه اتوآنالایزر بیوشیمی آزﻣﻮن اﻧﺪازهﮔﯿﺮی شد. شاخص مقاومت به انسولین HOMA-IR نیز ازطریق فرمول شماره 1 به دست آمد [24].
1.
HOMA-IR = گلوکز ناشتا (mmol/L)×انسولین ناشتا (µIU/ml)÷22/5
روش آماری
ازآمار توصیفی برای محاسبه میانگین از آزمون شاپیرو-ویلک برای تعیین توزیع طبیعی دادهها استفاده شد. از آزمون تی وابسته برای مقایسه تغییرات متغیرها قبل و بعد از تمرین و همچنین از آزمون تحلیل واریانس یکطرفه برای بررسی تغییرات بین تمرینها و همچنین برای بررسی ارتباط بین متغیرها از آزمون همبستگی پیرسون استفاده شد. با استفاده از نسخه 23 نرمافزار SPSS تمامی محاسبات تجزیهوتحلیل شدند و سطح معناداری آزمونها 0/05>P در نظر گرفته شد.
یافتهها
میانگین و انحرافمعیار شاخصهای آنتروپومتریکی (پیکرسنجی)، ترکیب بدنی و فیزیولوژیکی (vo2max)، میانگین زمان درماندگی و ضربان قلب تمرین آزمودنیهای مورد مطالعه در جدول شماره 2 نشان داده شده است.
.jpg)
نتایج آزمون آماری مربوط به آیریزین، انسولین، شاخص مقاومت انسولین و نیمرخ لیپیدی در جدول شماره 3 ارائه شده است.


باتوجهبه نتایج آزمون آماری بر روی آیریزین، مشخص شد که میزان این هورمون بین 2 نوع فعالیت برونگرا و درونگرا پس از 4 هفته مصرف مکمل زنجبیل در گروههای مکمل و تمرین افزایش معناداری یافته است (0/04=P). نتایج نشان داد تغییرات گلوکز (0/002=P) و انسولین (0/001=P) بین همه گروهها پس از 4 هفته مصرف مکمل زنجبیل بهترتیب کاهش و افزایش معنادار یافته است. همچنین مشخص شد تغییرات شاخص مقاومت به انسولین پس از 4 هفته مصرف مکمل زنجبیل بین همه گروهها کاهش جزیی و غیر معنادار است (0/08=P). نتایج آزمون همبستگی سطوح آیریزین با متغیرهای تحقیق در 2 نوع تمرین حاد برونگرا و درونگرا در جدول شماره 4 نشان داده شده است.
.jpg)
نتایج نشان داد بین سطوح آیریزین با انسولین و مقاومت به انسولین در تمرین درونگرا ارتباط مثبت معناداری وجود داشت (0/05>P)، درحالیکه در تمرین برونگرا بین سطوح آیریزین، گلوکز، انسولین و شاخص مقاومت به انسولین ارتباط معناداری مشاهده نشد.
بحث
براساس نتایج تحلیل واریانس یکطرفه این تحقیق 4 هفته مصرف مکمل زنجبیل بهدنبال فعالیت حاد برونگرا و درونگرا در گروه مکمل نسبت به گروه دارونما بر سطوح آیریزین سرم و انسولین افزایش معنادار و برگلوکز کاهش معنادار را نشان داد. همچنین 4 هفته مصرف مکمل زنجبیل بهدنبال فعالیت حاد برونگرا و درونگرا در گروه مکمل نسبت به گروه دارونما در سطوح کلسترول تام، تریگلیسرید ولیپوپروتئین با چگالی پایین در سطح معنا داری بود، اما در سطوح لیپوپروتئین با چگالی بالا معناداری نبود. ازجمله سازوکارهای احتمالی مطرحشده در مورد تأثیر احتمالی زنجبیل بر شاخصهای تنسنجی میتوان به افزایش گرمازایی و مصرف انرژی ازطریق آزادسازی کاتکولامینها، تجزیه سلولهای چربی در بافت چربی سفید و مهار آنزیم لیپاز لومن روده و درنتیجه کاهش چربی دریافتی اشاره کرد [25، 26]. زنجبیل میتواند چاقی را از طریق مکانیسمهای مختلف بالقوه ازجمله افزایش ترموژنز، افزایش لیپولیز، سرکوب لیپوژنز، مهار جذب چربی روده و کنترل اشتها تعدیل کند [26]. درخصوص اثر تمرینات ورزشی بر شاخصهای تنسنجی نیز برخی مطالعات انجامشده نشان دادهاند که انواع تمرینات هوازی و بیهوازی موجب کاهش محسوس در شاخصهای تنسنجی میشود [27].
آیریزین یک مایوکاین است که بهوسیله فعالیت ورزشی حاد تحریک شده و هزینه انرژی را افزایش داده است. درنتیجه نقش مهمی در چاقی و اختلالات متابولیکی دارد و بهعنوان یک هدف درمانی بالقوه در آینده میباشد [11]. بااینحال فیزیولوژی آن در انسان تا حد زیادی ناشناخته باقی مانده است. نتایج این پژوهش نشان داد آیریزین و مقاومت به انسولین افراد بعد از هر 2 نوع تمرین افزایش یافته است که بین 2 نوع تمرین ازنظر میزان آیریزین تفاوت معنا دار بوده، اما ازنظر افزایش مقاومت به انسولین تفاوت معناداری وجود نداشته است. یافتههای این پژوهش با نتایج مطالعات تسوچیا وهمکاران [9] و بوستروم و همکاران [7] همسو و با و هکستدن و همکاران [28] ناهمسو است. انقباضات عضله طی تمرین، یکی از دلایل افزایش ترشح آیریزین پس از تمرین در موش و انسان بیان شده است [7]. تسوچیا و همکاران سطح سرمی آیریزین را بر روی تردمیل در 2 شدت متفاوت 40 و 80 درصد vo2max اندازهگیری و به این نتیجه رسیدند که پاسخ آیریزین سرم به تمرین پرشدت بیشتر است که در راستای نتایج تحقیق حاضر است.
درمطالعه ای که اثر 1 جلسه فعالیت حاد و 8 هفته تمرین مزمن بر روی آیریزین 15 مرد جوان سالم تمرینکرده بررسی میشد، مشخص شد که در راستای کاهش ATP عضلانی و افزایش سوختوساز پس از فعالیت حاد، میزان آیریزین در گردش بهصورت معناداری افزایش یافته بود، اما میزان آیریزین در پاسخ به 8 هفته تمرین بدون تغییر بوده است. بنابراین باتوجهبه ارتباط بین غلظت آیریزین و تغییرات سوختوساز عضلانی در پاسخ به تمرین حاد میتوان چنین فرض کرد که بین آیریزین در گردش و ATP ارتباط وجود دارد و ممکن است یکی از دلایل تغییرنکردن آیریزین بعد از 8 هفته، عدم تغییر در ATP عضلانی باشد [18]. هکستدن و همکاران با بررسی 26 هفته تمرین ایروبیک با60 درصد ضربان قلب و تمرین استقامت عضلانی در افراد جوان به این نتیجه رسیدند که تفاوتی بین گروهها ازنظر میزان آیریزین وجود ندارد که تخریب آیریزین ناشی از طولانی بودن دوره انجماد نمونههای سرم را بهعنوان عامل اصلی اثرگذار بر نتیجه پژوهش خود بیان کرده است [28].
نتایج پژوهش یلدشده ناهمسو با نتایج پژوهش حاضر است. از علت ناهمسویی میتوان نوع آزمودنی یا شدت تمرین بیان کرد. برخی پژوهشگران معتقدند که اوج تغییرات آیریزین یک ساعت پس ازتمرین بوده که با گذشت زمان، مقادیرآن به سطح پایه برمیگردد [9]. برهمین اساس در پژوهش حاضر مشابه مطالعات دیگر [9، 30] نمونهگیری خونی بلافاصله پس از تمرین حاد انجام شد که شاید یکی از دلایل توجیهکننده افزایش آیریزین در مطالعه حاضر باشد. ازجمله دلایل عدم تغییر آیریزین را میتوان طولانیتر بودن دوره تمرینات دانست که منجر به سازگاری در افزایش آیریزین شده و احتمالاً شدت جلسات تمرینی جهت تحریک آیریزین ناکافی بوده است که با نتایج پژوهش حاضر متناقض میباشند. تفاوت کیتهای تجاری در مطالعات مختلف را نیز میتوان ازجمله عوامل نتایج مغایر با تحقیق حاضر دانست [31]. در برخی مطالعات نشان داده شده است که زنجبیل و مواد فعال موجود در آن بهویژه جینجرول میتواند موجب افزایش PGC-1 شود و از این نظر ممکن است بر سطوح آیریزین سرم مؤثر باشد [31]. در ارتباط با اثر تمرینات ورزشی در یک مطالعه، 8 هفته تمرینات تناوبی در زنان چاق، تغییر معناداری در آیریزین سرم ایجاد نکرد [32].
فعالیت زنجبیل را میتوان با تسریع در متابولیسم لیپیدها ازطریق مدولاسیون در بیان آنزیمهای مارکر [32] و مهار آن از میزان بیان پروتئین رتینوئید اتصالدهنده (RBP)mRNA در کبد و چربی احشایی که مربوط به متابولیسم لیپید است، نسبت داد. ژن و شاخص مهمی از هایپرلیپیدمی [32]. در همین حال ، زنجبیل با تنظیم بیان پروتئین اتصالدهنده عنصر پاسخ کربوهیدرات (ChREBP)، تبدیل کربوهیدراتهای اضافی به تریگلیسرید را مهار میکند [33]. علاوهبراین، اثر زنجبیل بر کاهش کلسترول سرم ممکن است بهدلیل اثر مهاری بیوسنتز کلسترول و تبدیل کلسترول به اسیدهای صفراوی با افزایش فعالیت کلسترول کبدی آلفا-هیدروکسیلاز باشد [32]. نیاسین، ماده مغذی موجود در زنجبیل [32] ، ممکن است یک ماده فعال بالقوه در کاهش سطح تری گلیسیرید سرم، افزایش ترشح VLDL ، افزایش جذب کبدی LDLc و مهار سنتز کلسترول باشد [33]. این نتایج با یافتههای پائولی، هواانلو و همکاران همسو بود [33 ،34].
بعضی تحقیقات نیز، از جمله المر و همکاران نشان داد 8 هفته اﺟﺮای تمرین تناوبی با شدت بالا، بر روی ﭘﺮوﻓﺎیﻞ ﻟﯿﭙﯿﺪی ﻣﺮدان ﺟﻮان ﺳﺎﻟﻢ ﺗﺄﺛﯿﺮ ﻣﻌﻨاداری ﻧﺪارد [35]. با وﺟﻮد ﻣﻄﺎﻟﻌﺎت بیانشده، المر گزارش کرد 8 هفته اﺟﺮای تمرین تناوبی شدید با شدت 80- درصد بیشینه اﮐﺴﯿﮋن ﻣﺼﺮﻓﯽ (3 ﺟﻠﺴﻪ در هفته)، ﺑﺮ ﭘﺮوﻓﺎیﻞ ﻟﯿﭙﯿﺪی 12 ﻣﺮد ﺟﻮان ﺳﺎﻟﻢ ﺗﺄﺛﯿﺮ ﻣﻌﻨاداری ﻧﺪاﺷﺖ. وی ﺷﺪت و ﻣﺪت ﺗﻤﺮیﻨﺎت را ﺑﺮ ایﻦ ﺷﺎﺧﺺها اﺛﺮﮔﺬار داﻧﺴﺖ [35]. دﻟﯿﻞ ناهمسویی یﺎﻓﺘﻪهای ﭘﮋوهش ﻓﻮق ﺑﺎ یﺎﻓﺘﻪهای پژوهش کنونی، پروتکل تمرینی و نوع آزمودنی بیان شد. پائولی و همکاران کاهش معنادار تریگلیسرید، لیپوپروتئین با چگالی پایین و کلسترول تام و افزایش لیپوپروتئین با چگالی بالا را ﭘﺲ از 12 هفته اﺟﺮای HIT با شدت 75 درصد ﺿﺮﺑﺎن ﻗﻠﺐ ذﺧﯿﺮه، ﮔﺰارش ﮐﺮدهاﻧﺪ [34].
هوانلو و همکاران در پژوهشی کاهش معنادار تریگلیسرید، لیپوپروتئین با چگالی پایین و کلسترول تام و افزایش لیپوپروتئین با چگالی بالا را در موشهای دیابتی، پس از 5 هفته تمرین هوازی بههمراه مصرف چای سبز ﮔﺰارش کردند [34]. دﻟﯿﻞ اﺣﺘﻤﺎﻟﯽ همسویی یافتههای دو پژوهش گفتهشده ﺑﺎ یﺎﻓﺘﻪهای پژوهش کنونی، شدت تمرین یا مصرف مکمل بیان شد. یافتههای پژوهش کنونی مبنی بر کاهش مقادیر تریگلیسرید، لیپوپروتئین با چگالی پایین و کلسترول تام و افزایش لیپوپروتئین با چگالی بالا با نتایج الرخ و همکاران همسو اﺳﺖ [36]. نوع ازمودنی یا نوع و شدت تمرین را علت همسویی برای پژوهشها یادشده میتوان بیان کرد.
مطالعات جی زو و همکاران نشان داد اثر مفید زنجبیل (یعنی کاهش قند خون ناشتا) ممکن است در بیماران مبتلا به هایپرگلیسمی برجستهتر از بدون هایپرگلیسمی باشد [37]. این یافته با مطالعات قبلی سازگار بود که نشان داد FBG بهطور قابلتوجهی کاهش یافته و عدم تحمل گلوکز پس از تجویز زنجبیل موشهای صحرایی دیابتی بهطور قابلتوجهی بهبود یافته است [38]. مکانیسم اساسی شامل مهار α-گلوکزیداز و α-آمیلاز است که آنزیمهای کلیدی در هضم و جذب کربوهیدراتهای پیچیده هستند [39]. علاوهبراین، 6-زنجبیل، یک جزء زنجبیل، فعالیت مهمی در تحریک متابولیسم گلوکز از طریق مسیر AS160-Rab5 با واسطه AMPKalpha2 و از طریق تقویت تنظیم گلوکز واسطه انسولین نشان داد [40].
6-پارادول و 6-شوگائول که ترکیبات تند زنجبیل هستند، تأثیرات یکسانی دارند [41]. زنجبیل همچنین میتواند بیانگر انتقالدهنده گلوکز نوع4 [35] را گلوکز نوع 4 را افزایش دهد تا جذب گلوکز را در سلولهای چربی و سلولهای عضلانی اسکلتی تقویت کند [42]. علاوهبراین، زنجبیل میتواند سطح انسولین ناشتا و HOMA-IR را کاهش دهد. حساسیت به انسولین را میتوان با تنظیم تنظیم آدیپونکتین و گیرنده فعالکننده پرولیفراتیو پراکسیزوم (γ (PPAR γ [36] و با تعامل سازنده زنجبیل با گیرنده 5-HT3 افزایش داد [42]. درعینحال 6-زنجبیل که از زنجبیل استخراج میشود، میتواند از سلولهای β پانکراس محافظت کند [43]. کاهش HbA1c بیشتر نشان میدهد که زنجبیل دارای اثر طولانی مدت در کاهش قند خون است.
یافتههای پژوهش حاضر نشان داد مقاومت به انسولین پس از یک جلسه تمرین برونگرا ودرونگرا افزایش جزیی پیدا کرده که با مطالعات قنبری نیاکی و همکاران [44] همخوان است. از دلایل همخوانی میتوان نوع و شدت تمرین بیان کرد. همچنین تغییرات انسولین و گلوکز میتواند موجب تغییر در مقاومت و حساسیت انسولینی بدن شود. بنابراین این احتمال وجود دارد که تمرین برونگرا و درونگرا تأثیری را بر بیان پروتئین گلوکز نوع4 نگذاشته است و ازطرفی چون باعث افزایش در انسولین و گلوکز سرم بعد از هر 2 نوع تمرین شد، بنابراین این تغییرات، افزایش مقاومت به انسولین را به همراه خواهد داشت. در تحقیق فیلیپ و همکاران مشخص شد که بعد از یک دوره 1ساعته تمرین درونگرا و یک دوره تمرین1ساعته بدون آسیب برونگرا با شدت 55%VO2max ، تغییرات گلوکز بهبود مییابد (1و 2ساعت بعد از تمرین درونگرا و 1ساعت بعد از تمرین برونگرا) که با یافتههای پژوهش ما ناهمسو است [45]. از جمله دلایل احتمالی تفاوت نتایج در پژوهش حاضر میتوان به آثار احتمالی خستگی و آسیب ناشی از تمرین شدید درونگرا و برونگرا بر مکانیسم گلوکز و شاخص مقاومت به انسولین و همچنین کوتاه بودن دوره انجام فعالیت و شدت بالای تمرینات در تحقیق حاضر، بهعنوان عوامل مؤثر بر عدم تأثیر در بهبود مقاومت به انسولین نام برد.
ترشح آیریزین در خون بهوسیله افزایش در بیان ژن پروتئین UCP1، باعث بهبود مقاومت به انسولین و درنهایت منجر به قهوهای شدن بافت چربی سفید میشود. PGC1-ɑ ترشح آیریزین را افزایش میدهد ودر بیوسنتز میتوکندریایی شرکت میکند و متابولیسم اکسیداتیو را بهبود میبخشد [7]. میتوکندری نقش مهمی را در مقاومت به انسولین ایفا میکند و کاهش در بیان یا عملکردPGC1-ɑ باعث ایجاد مقاومت به انسولین و دیابت میشود [46].
براساس یافتههای این پژوهش در تمرین برونگرا بین آیریزین سرم و شاخص مقاومت به انسولین ارتباط معناداری مشاهده نشد. شاید یکی از دلایل معنادار نبودن ارتباط را بتوان به تعداد کم نمونههای این مطالعه نسبت داد. ممکن است ناشتا بودن آزمودنیها در هردو مرحله از خونگیری و همچنین مدت کوتاه و شدت بالای تمرین دلیلی بر عدم بهبود مقادیر گلوکز، انسولین و مقاومت به انسولین باشد. تیمونز و همکاران در سال 2012، بهبود شاخص مقاومت انسولینی در اثر تمرین را تأیید و ارتباط بین آیریزین و مقاومت انسولین را رد کردند. بوستروم در جواب به تیمونز توضیح داد که روش سنجش متفاوت تمیونز را میتوان دلیلی برای وجود این اختلاف در پژوهش دانست [47].
همچنین در پژوهش حاضر مشخص شد بین سطوح سرمی آیریزین و شاخص مقاومت به انسولین در زنان چاق در تمرین درونگرا ارتباط مستقیم معناداری وجود دارد که علت این ارتباط را شاید بتوان به افزایش انسولین و نقش آیریزین در حفظ سیگنال انسولین دانست. با درنظر گرفتن تأثیر عواملی ازقبیل شدت و مدت تمرین و همچنین تأثیر احتمالی نوع انقباضات عضلانی حین تمرین، افزایش آیریزین در پژوهش حاضر قابل توجیه است که ممکن است هرکدام از این عوامل و شاید ناشتا بودن آزمودنیها در هر 2 مرحله از خونگیری باعث عدم بهبود مقاومت به انسولین در افراد چاق شده باشد.
عدم ارزیابی بیان ژن FNDC5 وPGC-1ɑ، یکسان نبودن مدت زمان و هزینه انرژی تمرین برای همه آزمودنیها و همچنین تفاوت افراد در پاسخ به خستگی و التهاب ناشی از تمرین و تأثیر احتمالی آنها بر ترشح آیریزین، بهعنوان محدودیتهای موجود در پژوهش حاضر میباشند.
نتیجه گیری
نتایج این پژوهش نشان داد ﻣﺼﺮف مکمل زﻧﺠﺒﻴﻞ به همراه دو نوع فعالیت برونگرا و درونگرا میﺗﻮاﻧﺪ تا حدودی ﺑﺮای کاهش گلوکزوﺗﻐﻴﻴﺮات ﻣﻄﻠﻮب در آیریزین، ﻣﻘﺎوﻣﺖ ﺑﻪ اﻧﺴﻮﻟﻴﻦ و نیمرخهای لیپیدی در زنان چاق مؤثر ﺑﺎﺷﺪ.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
کلیه شیوههای انجامشده در مطالعه در مورد شرکتکنندگان انسانی مطابق با معیارهای کمیته اخلاق همرا با کد اخلاق کد اخلاق IR.MEDILAM.REC.1395.192 است.
حامی مالی
این مقاله برگرفته از طرح پژوهشی مصوب دانشگاه لرستان است.
مشارکت نویسندگان
مفهومسازی، نگارش متن و بازبینی: اسما سلیمانی، محمد فتحی؛ روش پژوهش، نمونهگیری و تحلیل دادهها: اسما سلیمانی.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
References
1.Zou C, Shao J. Role of adipocytokines in obesity-associated insulin resistance. J Nutr Biochem. 2008; 19(5):277-86. [DOI:10.1016/j.jnutbio.2007.06.006] [PMID]
2.Batsis JA, Nieto-Martinez RE, Lopez-Jimenez F. Metabolic syndrome: From global epidemiology to individualized medicine. Clin Pharmacol Ther. 2007; 82(5):509-24. [DOI:10.1038/sj.clpt.6100355] [PMID]
3.World Health Organization (WHO). Obesity and overweight. Geneva: World Health Organization; 2016. [Link]
4.Patel S, Hoehn K, Lawrence R, Sawbridge L, Talbot N, Tomsig J, et al. Overexpression of the adiponectin receptor AdipoR1 in rat skeletal muscle amplifies local insulin sensitivity. Endocrinology. 2012; 153(11):5231-46. [DOI:10.1210/en.2012-1368] [PMID] [PMCID]
5.Pedersen BK. A muscular twist on the fate of fat. N Engl J Med. 2012; 366(16):1544-5. [DOI:10.1056/NEJMcibr1201024] [PMID]
6.Pedersen BK, Febbraio MA. Muscles, exercise and obesity: Skeletal muscle as a secretory organ. Nat Rev Endocrinol. 2012; 8(8):457-65. [DOI:10.1038/nrendo.2012.49] [PMID]
7.Boström P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature. 2012; 481(7382):463-8. [DOI:10.1038/nature10777] [PMID] [PMCID]
8.Arias-Loste MT, Ranchal I, Romero-Gómez M, Crespo J. Irisin, a link among fatty liver disease, physical inactivity and insulin resistance. Int J Mol Sci. 2014; 15(12):23163-78. [DOI:10.3390/ijms151223163] [PMID] [PMCID]
9.Wu J, Ruas JL, Estall JL, Rasbach KA, Choi JH, Ye L, e al. The unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1α/ATF6α complex. Cell Metab. 2011; 13(2):160-9. [DOI:10.1016/j.cmet.2011.01.003] [PMID] [PMCID]
10.Moreno-Navarrete JM, Ortega F, Serrano M, Guerra E, Pardo G, Tinahones F, et al. Irisin is expressed and produced by human muscle and adipose tissue in association with obesity and insulin resistance. J Clin Endocrinol Metab. 2013; 98(4):E769-78. [DOI:10.1210/jc.2012-2749] [PMID]
11.Zeppetzauer M, Drexel H, Vonbank A, Rein P, Aczel S, Saely CH. Eccentric endurance exercise economically improves metabolic and inflammatory risk factors. Eur J Prev Cardiol. 2013; 20(4):577-84. [DOI:10.1177/2047487312444236] [PMID]
12.Paschalis V, Nikolaidis MG, Theodorou AA, Panayiotou G, Fatouros IG, Koutedakis Y, et al. A weekly bout of eccentric exercise is sufficient to induce health-promoting effects. Med Sci Sports Exerc. 2011; 43(1):64-73. [DOI:10.1249/MSS.0b013e3181e91d90] [PMID]
13.Wojtaszewski JF, Nielsen JN, Richter EA. Invited review: Effect of acute exercise on insulin signaling and action in humans. J Appl Physiol. 2002; 93(1):384-92. [DOI:10.1152/japplphysiol.00043.2002] [PMID]
14.Kirwan J, Del Aguila L. Insulin signalling, exercise and cellular integrity. Biochem Soc Trans. 2003; 31(Pt 6):1281-5. [DOI:10.1042/bst0311281] [PMID]
15.Wang J, Ke W, Bao R, Hu X, Chen F. Beneficial effects of ginger Zingiber officinale roscoe on obesity and metabolic syndrome: A review. Ann N Y Acad Sci. 2017; 1398(1):83-98. [DOI:10.1111/nyas.13375] [PMID]
16.Zaer Ghodsi N, Zolfaghari MR, Fattah A. The impact of high intensity interval training on lipid profile, inflamematory markers and anthropometric parameters in inactive women. Med Lab J. 2016; 10(1):56-60. [DOI:10.18869/acadpub.mlj.10.1.56]
17.Löffler D, Müller U, Scheuermann K, Friebe D, Gesing J, Bielitz J, et al. Serum irisin levels are regulated by acute strenuous exercise. J Clin Endocrinol Metab. 2015; 100(4):1289-99. [DOI:10.1210/jc.2014-2932] [PMID]
18.Tsuchiya Y, Ando D, Goto K, Kiuchi M, Yamakita M, Koyama K. High-intensity exercise causes greater irisin response compared with low-intensity exercise under similar energy consumption. Tohoku J Exp Med. 2014; 233(2):135-40. [DOI:10.1620/tjem.233.135] [PMID]
19.Daskalopoulou SS, Cooke AB, Gomez YH, Mutter AF, Filippaios A, Mesfum ET, et al. Plasma irisin levels progressively increase in response to increasing exercise workloads in young, healthy, active subjects. Eur J Endocrinol. 2014; 171(3):343-52. [DOI:10.1530/EJE-14-0204] [PMID]
20.Verma SK, Singh M, Jain P, Bordia A. Protective effect of ginger, zingiber officinale Rosc on experimental atherosclerosis in rabbits. Indian J Exp Biol. 2004; 42(7):736-8. [PMID]
21.Shirdel Z, Mirbalad Zade R, Madani H. [Effect of anti diabetic and anti lipidemic of ginger in diabetic rats for aloxan mono hidrate and compare with gliben clamid (Persian)]. Iran J Diabetes Metab. 2009; 9(1):7-15. [Link]
22.Pollock ML, Foster C, Schmidt D, Hellman C, Linnerud AC, Ward A. Comparative analysis of physiologic responses to three different maximal graded exercise test protocols in healthy women. Am Heart J. 1982; 103(3):363-73. [DOI:10.1016/0002-8703(82)90275-7] [PMID]
23.Ellestad MH, Allen W, Wan MC, Kemp GL. Maximal treadmill stress testing for cardiovascular evaluation. Circulation. 1969; 39(4):517-22. [DOI:10.1161/01.CIR.39.4.517] [PMID]
24.Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: Insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985; 28(7):412-9. [DOI:10.1007/BF00280883] [PMID]
25.Ahn EK, Oh JS. Inhibitory effect of galanolactone isolated from Zingiber officinale roscoe extract on adipogenesis in 3T3-L1 cells. J Korean Soc Appli Biol Chem. 2012; 55:63-8. [DOI:10.1007/s13765-012-0011-6]
26.Racil G, Ben Ounis O, Hammouda O, Kallel A, Zouhal H, Chamari K, et al. Effects of high vs. moderate exercise intensity during interval training on lipids and adiponectin levels in obese young females. Eur J Appl Physiol. 2013; 113(10):2531-40. [DOI:10.1007/s00421-013-2689-5] [PMID]
27.Huh JY, Panagiotou G, Mougios V, Brinkoetter M, Vamvini MT, Schneider BE, et al. FNDC5 and irisin in humans: I. predictors of circulating concentrations in serum and plasma and II. mRNA expression and circulating concentrations in response to weight loss and exercise. Metabolism. 2012; 61(12):1725-38. [DOI:10.1016/j.metabol.2012.09.002] [PMID] [PMCID]
28.Hecksteden A, Wegmann M, Steffen A, Kraushaar J, Morsch A, Ruppenthal S, et al. Irisin and exercise training in humans-results from a randomized controlled training trial. BMC Med. 2013; 11:235. [DOI:10.1186/1741-7015-11-235] [PMID] [PMCID]
29.Shoukry A, Shalaby SM, El-Arabi Bdeer S, Mahmoud AA, Mousa MM, Khalifa A. Circulating serum irisin levels in obesity and type 2 diabetes mellitus. IUBMB Life. 2016; 68(7):544-56. [DOI:10.1002/iub.1511] [PMID]
30.Brahma Naidu P, Uddandrao VV, Ravindar Naik R, Suresh P, Meriga B, Begum MS, et al. Ameliorative potential of gingerol: Promising modulation of inflammatory factors and lipid marker enzymes expressions in HFD induced obesity in rats. Mol Cell Endocrinol. 2016; 419:139-47. [DOI:10.1016/j.mce.2015.10.007] [PMID]
31.Gao H, Guan T, Li C, Zuo G, Yamahara J, Wang J, et al. Treatment with ginger ameliorates fructose-induced fatty liver and hypertriglyceridemia in rats: Modulation of the hepatic carbohydrate response element-binding protein-mediated pathway. Evid Based Complement Alternat Med. 2012; 2012:570948. [DOI:10.1155/2012/570948] [PMID] [PMCID]
32.Zhu J, Chen H, Song Z, Wang X, Sun Z. Effects of ginger (Zingiber officinale roscoe) on type 2 diabetes mellitus and components of the metabolic syndrome: A systematic review and meta-analysis of randomized controlled trials. Evid Based Complement Alternat Med. 2018; 2018:5692962. [DOI:10.1155/2018/5692962] [PMID] [PMCID]
33.Paoli A, Pacelli QF, Moro T, Marcolin G, Neri M, Battaglia G, et al. Effects of high-intensity circuit training, low-intensity circuit training and endurance training on blood pressure and lipoproteins in middle-aged overweight men. Lipids Health Dis. 2013; 12:131. [DOI:10.1186/1476-511X-12-131] [PMID] [PMCID]
34.Hovanloo F, Shahvali Koohshoori Y, Teimoorian M, Saadati M, Fallah Huseini H. The effect of aerobic training combined and green tea (camellia sinensis l.) extract consumption on blood glucose and lipid profile in streptozotocin induced diabetic rats. J Med Plants. 2014; 13(51):84-92. [Link]
35.Elmer D. Effect of 8 weeks of high-intensity interval training versus traditional endurance training on the blood lipid profile in humans [PhD thesis]. Auburn: AUBURN University; 2013. [Link]
36.ElRokh el-SM, Yassin NA, El-Shenawy SM, Ibrahim BM. Antihypercholesterolaemic effect of ginger rhizome (Zingiber officinale) in rats. Inflammopharmacology. 2010; 18(6):309-15. [DOI:10.1007/s10787-010-0053-5] [PMID]
37.Lee JO, Kim N, Lee HJ, Moon JW, Lee SK, Kim SJ, et al. [6]-gingerol affects glucose metabolism by dual regulation via the AMPKα2-mediated AS160-Rab5 pathway and AMPK-mediated insulin sensitizing effects. J Cell Biochem. 2015; 116(7):1401-10. [DOI:10.1002/jcb.25100] [PMID]
38.Madkor HR, Mansour SW, Ramadan G. Modulatory effects of garlic, ginger, turmeric and their mixture on hyperglycaemia, dyslipidaemia and oxidative stress in streptozotocin-nicotinamide diabetic rats. Br J Nutr. 2011; 105(8):1210-7. [DOI:10.1017/S0007114510004927] [PMID]
39.Priya Rani M, Padmakumari KP, Sankarikutty B, Lijo Cherian OL, Nisha VM, Raghu KG. Inhibitory potential of ginger extracts against enzymes linked to type 2 diabetes, inflammation and induced oxidative stress. Int J Food Sci Nutr. 2011; 62(2):106-10. [DOI:10.3109/09637486.2010.515565] [PMID]
40.Wei CK, Tsai YH, Korinek M, Hung PH, El-Shazly M, Cheng YB, et al. 6-Paradol and 6-Shogaol, the pungent compounds of ginger, promote glucose utilization in adipocytes and myotubes, and 6-Paradol reduces blood glucose in high-fat diet-fed mice. Int J Mol Sci. 2017; 18(1):168. [DOI:10.3390/ijms18010168] [PMID] [PMCID]
41.Rani MP, Krishna MS, Padmakumari KP, Raghu KG, Sundaresan A. Zingiber officinale extract exhibits antidiabetic potential via modulating glucose uptake, protein glycation and inhibiting adipocyte differentiation: An in vitro study. J Sci Food Agric. 2012; 92(9):1948-55. [DOI:10.1002/jsfa.5567] [PMID]
42.Li Y, Tran VH, Duke CC, Roufogalis BD. Gingerols of Zingiber officinale enhance glucose uptake by increasing cell surface GLUT4 in cultured L6 myotubes. Planta Med. 2012; 78(14):1549-55. [DOI:10.1055/s-0032-1315041] [PMID]
43.Ghanbari-Niaki A, Saghebjoo M, Soltani R, Kirwan JP. Plasma visfatin is increased after high-intensity exercise. Ann Nutr Metab. 2010; 57(1):3-8. [DOI:10.1159/000313936] [PMID]
44.Philippe M, Krüsmann PJ, Mersa L, Eder EM, Gatterer H, Melmer A, et al. Acute effects of concentric and eccentric exercise on glucose metabolism and interleukin-6 concentration in healthy males. Biol Sport. 2016; 33(2):153-8. [DOI:10.5604/20831862.1198634] [PMID] [PMCID]
45.Patti ME, Butte AJ, Crunkhorn S, Cusi K, Berria R, Kashyap S, et al. Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes: Potential role of PGC1 and NRF1. Proc Natl Acad Sci U S A. 2003; 100(14):8466-71. [DOI:10.1073/pnas.1032913100] [PMID] [PMCID]
46.Timmons JA, Baar K, Davidsen PK, Atherton PJ. Is irisin a human exercise gene? Nature. 2012; 488(7413):E9-10; discussion E10-1. [DOI:10.1038/nature11364] [PMID]
47.Yang Z, Chen X, Chen Y, Zhao Q. Decreased irisin secretion contributes to muscle insulin resistance in high-fat diet mice. Int J Clin Exp Pathol. 2015; 8(6):6490-7. [PMID] [PMCID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |








