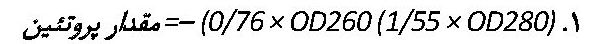دوره 22، شماره 6 - ( بهمن و اسفند 1398 )
جلد 22 شماره 6 صفحات 181-170 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Khaki M, Abtahi H, Mosayebi G. The Effect of Chemical Additives in Refolding of Recombinant Vascular Endothelial Growth Factor. J Arak Uni Med Sci 2020; 22 (6) :170-181
URL: http://jams.arakmu.ac.ir/article-1-6206-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6206-fa.html
خاکی محسن، ابطحی حمید، مسیبی قاسم. ارزیابی تأثیر مواد افزودنی شیمیایی در تاخوردگی مجدد فاکتور رشد اندوتلیال عروقی نوترکیب. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (6) :170-181
محسن خاکی1 

 ، حمید ابطحی
، حمید ابطحی 

 2، قاسم مسیبی1
2، قاسم مسیبی1 




 ، حمید ابطحی
، حمید ابطحی 

 2، قاسم مسیبی1
2، قاسم مسیبی1 


1- مرکز تحقیقات پزشکی و مولکولی، دانشگاه علوم پزشکی اراک، اراک، ایران.
2- مرکز تحقیقات پزشکی و مولکولی، دانشگاه علوم پزشکی اراک، اراک، ایران. ، abtahi@arakmu.ac.ir
2- مرکز تحقیقات پزشکی و مولکولی، دانشگاه علوم پزشکی اراک، اراک، ایران. ، abtahi@arakmu.ac.ir
متن کامل [PDF 2490 kb]
(874 دریافت)
| چکیده (HTML) (2380 مشاهده)
مرحله بازآرایی پروتئین
عطف به مطالب ذکرشده درقسمت مقدمه، در خصوص چالشهای فناوری تولید و بازآرایی پروتئین نوترکیب [11]، در اجرای این طرح، برای صرفهجویی در وقت و هزینهها، ابتدا با بهرهگیری از نرمافزارها، الگوی اصلاح ساختار پروتئین نوترکیب با حضورمکملهای شیمیایی مختلف در بافر دیالیز، شبیهسازی شد. ابتدا با ExPASy server، مقدار pH پروتئین هدف، تعیین شد. سپس با برنامه Aggre scan server، نواحی حساس اگریگیشن پروتئینی پیشبینی شد. با استفاده از بانک اطلاعات پروتئین، ساختار کریستالوگرافی VEGF، مشخص شد.
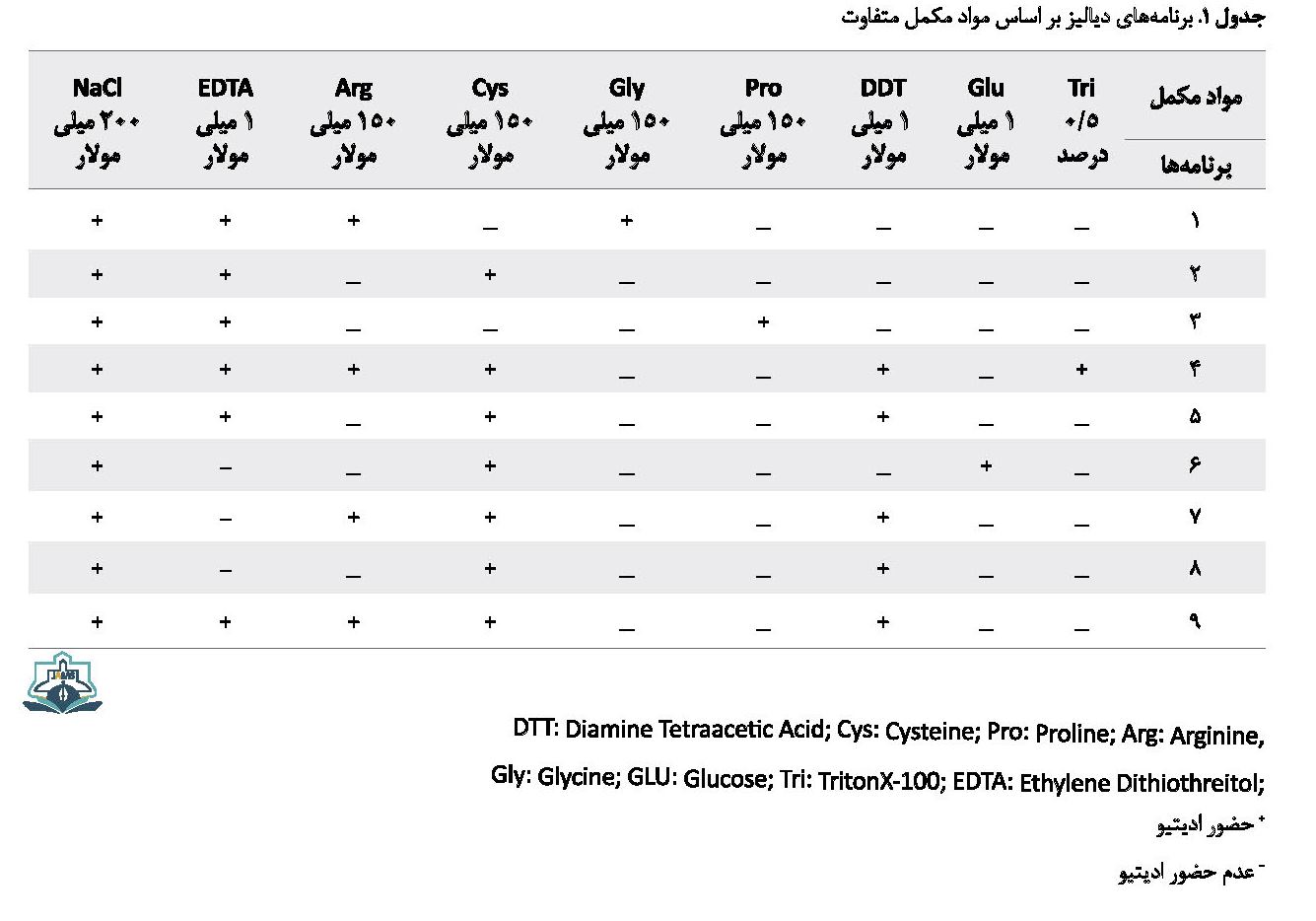
برای همسانسازی ساختار پروتئین از نرمافزار ویرایشگر Chimera Photo، استفاده شد. ساختار سهبعدی اسید امینههای موردنظر (سیستئین، پرولین، گلایسین و آرژنین)، از سایت PubChem، استخراج شد. با بهرهگیری از برنامه Hyperchem، انرژی همسانسازی پروتئین با مواد مکمل مختلف، مشخص شد [12]. جهت پیشبینی فرایند باراندازی اسیدهای امینه و مکملهای شیمیایی با نواحی حساس VEGF (داکینگ)، از نرمافزار AutoDock استفاده شد [13]. در انتها از نرمافزار LigPlot، جهت پیشگویی واکنشهای لیگاندهای هیدروژنیک و هیدروفوبیک VEGF-A و ارزیابی طول باندهای هیدروژنی پروتئین، استفاده شد [14]. برای دیالیز شیمیایی پروتئین، ابتدا بافر پایه PBS تهیه شد و سپس طبق جدول شماره 1 با انتخاب مکمل شیمیایی مختلف، 9 برنامه دیالیز روی محصول پروتئین تولیدشده، اجرا شد.
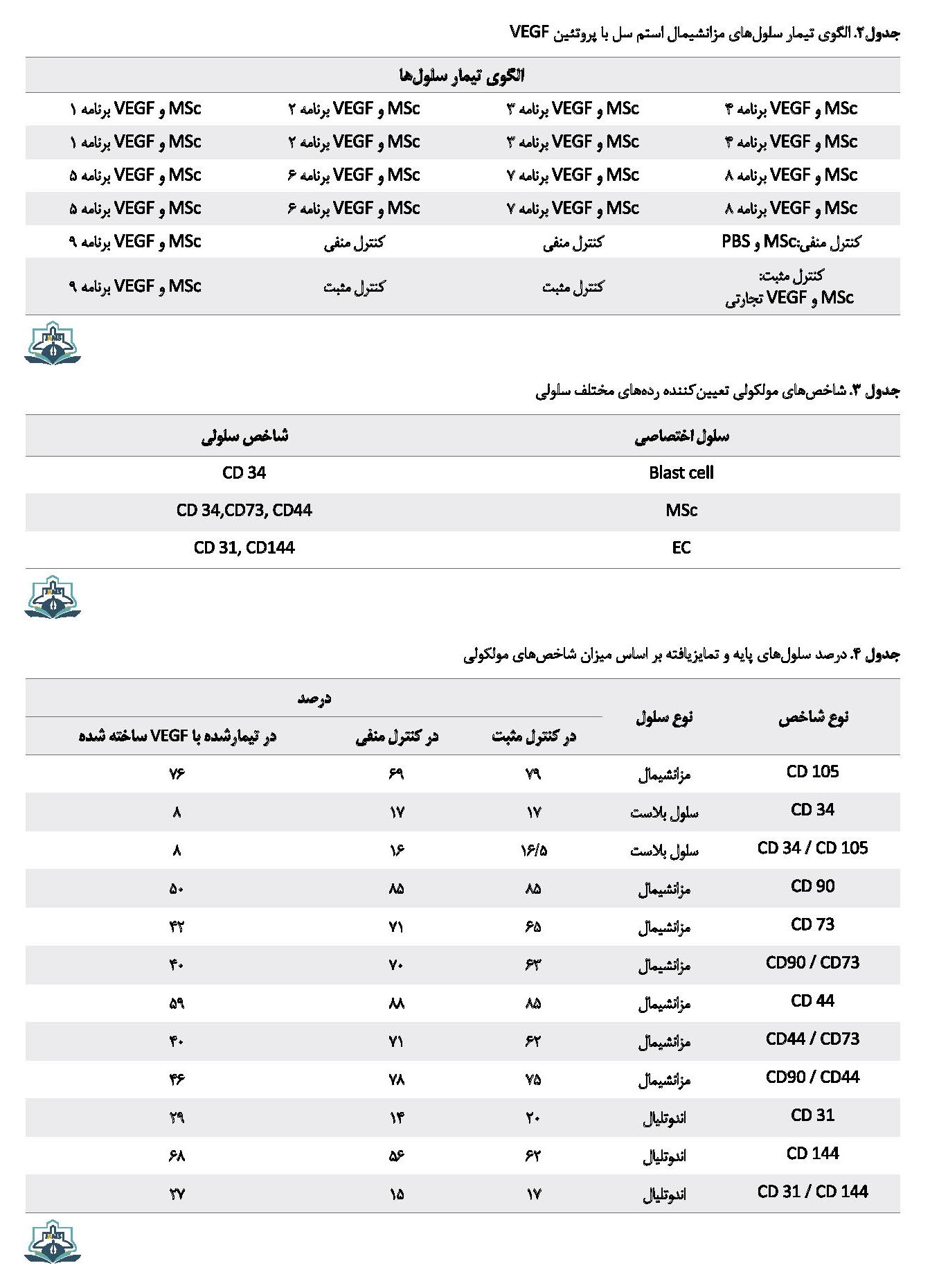
برای ارزیابی اثربخشی فرایند بازآرایی محصول بهدستآمده، از 9 برنامه دیالیز، جهت تیمار سلول پایه مزانشیمال و تمایز آن به سلول اندوتلیال (EC)، استفاده شد. ابتدا در یک پلیت کشت سلولی 24خانهای با گودههای تخت، در هر گوده، 5000 سلول MSc ریخته شد. در تراکم سلولی 50 درصد، طبق جدول شماره 2، تیمار سلولها به مدت 10 روز انجام شد. برای افزایش دقت آزمایش، در مورد گودههای تیمارشده با VEGF دستساز، به صورت دو گوده (دوپلیکیت) و در مورد کنترلها، تیمار در سه گوده (تریپلیکیت) انجام شد. از پروتئین تجارتی شرکت abcam (ab9571)، به عنوان کنترل مثبت استفاده شد.
برای ارزیابی میزان تمایز MSC به EC به روش فلوسایتومتری، شاخصهای اختصاصی (CD Markers) سلولهای مورد نظر، مورد ارزیابی قرار گرفت (جدول شماره 3).
تجزیه و تحلیل دادهها با آزمون تی مستقل و من ویتنی یو، انجام شد. میانگین و انحراف معیار دادهها، با نسخه 16 برنامه SPSS (IBMB corporation, NY, USA) محاسبه شد. حد معنیداری با P value کمتر از 0/05، مشخص شد.
یافتهها
به استناد دادههای پایگاه Expasi، میزان pH ایزو الکتریک (pI) VEGF-A، 2/9 تعیین شد و بر اساس آن میزان pH بافر پایه دیالیز، هشت در نظر گرفته شد. نتایج نرمافزار LigPlot، نشان داد که بین سیستئین و VEGF، باندهای هیدروژنی ضعیفتری نسبت به سایر اسیدهای امینه، ایجاد میشود. دادهها از سرور aggre scan، نواحی حساس تجمع پروتئین برای VEGF را مشخص کرد. این مکانها در تصویر شماره 1 با حروف درشت، نمایش داده شده است. بر اساس نتایج فلوسایتومتری، درصد سلولهای پایه و تمایزیافته بر اساس میزان شاخصهای مولکولی با روش فلو سایتومتری، مشخص شد (جدول شماره 4).
بحث
در ارزیابی عملکرد VEGF نوترکیب در ایجاد تمایز در سلولهای مزانشیمال به سلول اندوتلیال، دادههای این مطالعه نشان داد که شیب کاهش درصد شاخصهای سلولهای مزانشیمال، در سلولهای تیمارشده با پروتئین نوترکیب، نسبت به سلولهای تیمارشده با VEGF تجارتی، تندتر بود. این نتیحه مؤید تأثیر بیشتر VEGF ساختهشده نسبت به پروتئین تجارتی بود. این مطلب میتواند مؤید مناسببودن روش اصلاح ساختار پروتئین، در این مطالعه باشد؛ زیرا با بهرهگیری از روش شبیهسازی پروتئین در محیط مجازی، فرایند تاخوردگی مجدد پروتئین نوترکیب، هدفمند و انتخابی اجرا شد. نکته قابل بیان دیگر اینکه ممکن است پروتئین تجارتی خریداریشده و وارداتی، در پروسه نگهداری و حملونقل توسط شرکتهای داخلی که خارج از کنترل این مطالعه هستند، تا حدی فعالیتش را از دست داده باشد.
References
Yamagishi N, Teshima-Kondo S, Masuda K, Nishida K, Kuwano Y, Dang DT, et al. Chronic inhibition of tumor cell-derived VEGF enhances the malignant phenotype of colorectal cancer cells. BMC Cancer. 2013; 13(1):229. [DOI:10.1186/1471-2407-13-229] [PMID] [PMCID]
Lee SB, Park JS, Lee S, Park J, Yu S, Kim H, et al. Overproduction of recombinant human VEGF (vascular endothelial growth factor) in Chinese hamster ovary cells. J Microbiol Biotechnol. 2008; 18(1):183-7.
Vempati P, Popel AS, Mac Gabhann F. Extracellular regulation of VEGF: Isoforms, proteolysis, and vascular patterning. Cytokine Growth Factor Rev. 2014; 25(1):1-19. [DOI:10.1016/j.cytogfr.2013.11.002] [PMID] [PMCID]
Atilgan E, Hu J. Improving protein docking using sustainable genetic algorithms. Int J Compu Inoform Sys Ind Manag App. 2011; 3:248-55.
Khaki M, Salmanian AH, Abtahi H, Ganji A, Mosayebi G. Mesenchymal Stem Cells Differentiate to Endothelial Cells Using Recombinant Vascular Endothelial Growth Factor-A. Rep Biochem Mol Biol. 2018; 6(2):144-50. [PMID] [PMCID]
Kinashi H, Ito Y, Sun T, Katsuno T, Takei Y. Roles of the TGF-β-VEGF-C pathway in fibrosis-related lymphangiogenesis. Int J Mol Sci. 2018; 19(9):E2487. [DOI:10.3390/ijms19092487] [PMID] [PMCID]
Abbasian S, Soufian S, Nejad A, Abtahi H. Investigating the possibility of recombination the predicted antigenic fragment of Streptococcus pyogen hyaluronidase by bioinformatics softwares. Koomesh. 2015; 17(1):77-83.
Mirjamali NAS, Soufian S, Molaee N, Abbasian SS, Abtahi H. Cloning and expression of the enzymatic region of Streptococcal hyaluronidase. Iran J Basic Med Sci. 2014; 17(9):667-72. [PMID] [PMCID]
Didevara E, Abtahi H. Cloning and production of the monomer form of recombinant streptavidin and appraisal of its binding affinity to biotin. Koomesh. 2018; 20(1):115-21.
Hamzehloo Z, Mosayebi Gh, Khansarinejad B, Zolfaghari M, Abtahi H. Antigenicity Identification of a Novel Recombinant Multi-Epitope Antigen Based on FlaA and UreB Antigens of Helicobacter pylori. Jundishapur J Microbiol. 2019; 12(5):e66502.
Morozova VV, Vlassov VV, Tikunova NV. Applications of bacteriophages in the treatment of localized infections in humans. Front Microbiol. 2018; 9:1696. [DOI:10.3389/fmicb.2018.01696] [PMID] [PMCID]
Bystrov VS, Bdikin IK, Silibin M, Karpinsky D, Kopyl S, Paramonova EV, et al. Molecular modeling of the piezoelectric properties of ferroelectric composites containing Polyvinylidene Fluoride (PVDF) and either graphene or graphene oxide. J Mol Model. 2017; 23(4):128. [DOI:10.1007/s00894-017-3291-2] [PMID]
Mohamadyar-Toupkanlou F, Esfandiari M, Kashef-Saberi MS, Renani MK, Soleimani M. The structural bioinformatics analysis of biophenolic lignan-estrogen receptor interaction. Curr Cancer Drug Targets. 2017. [DOI:10.2174/1568009617666170623121446] [PMID]
Wallace AC, Laskowski RA, Thornton JM. LIGPLOT: A program to generate schematic diagrams of protein-ligand interactions. Protein Eng Des Sel. 1995; 8(2):127-34. [DOI:10.1093/protein/8.2.127] [PMID]
Claffey KP, Senger DR, Spiegelman BM. Structural requirements for dimerization, glycosylation, secretion, and biological function of VPF/VEGF. Biochim Biophys Acta. 1995; 1246(1):1-9. [DOI:10.1016/0167-4838(94)00144-6]
Walker KW, Lyles MM, Gilbert HF. Catalysis of oxidative protein folding by mutants of protein disulfide isomerase with a single active-site cysteine. Biochem. 1996; 35(6):1972-80. [DOI:10.1021/bi952157n] [PMID]
Cothran A, St John RJ, Schmelzer CH, Pizarro SA. High-pressure refolding of human Vascular Endothelial Growth Factor (VEGF) recombinantly expressed in bacterial inclusion bodies: Refolding optimization, and feasibility assessment. Biotechnol Prog. 2011; 27(5):1273-81. [DOI:10.1002/btpr.642] [PMID]
Buchner J, Rudolph R. Renaturation, purification and characterization of recombinant Fab-fragments produced in Escherichia coli. Biotechnology (N Y). 1991; 9(2):157-62. [DOI:10.1038/nbt0291-157] [PMID]
Inoue N, Takai E, Arakawa T, Shiraki K. Arginine and lysine reduce the high viscosity of serum albumin solutions for pharmaceutical injection. J Biosci Bioeng. 2014; 117(5):539-43. [DOI:10.1016/j.jbiosc.2013.10.016] [PMID]
Arakawa T, Kita Y. Multi-faceted arginine: Mechanism of the effects of arginine on protein. Curr Protein Pept Sci. 2014; 15(6):608-20. [DOI:10.2174/138920371506140818113015] [PMID]
Arora D, Khanna N. Method for increasing the yield of properly folded recombinant human gamma interferon from inclusion bodies. J Biotechnol. 1996; 52(2):127-33. [DOI:10.1016/S0168-1656(96)01636-7]
Xia Y, Park YD, Mu H, Zhou HM, Wang XY, Meng FG. The protective effects of osmolytes on arginine kinase unfolding and aggregation. Int J Biol Macromol. 2007; 40(5):437-43. [DOI:10.1016/j.ijbiomac.2006.10.004] [PMID]
Lilie H, Schwarz E, Rudolph R. Advances in refolding of proteins produced in E. coli. Curr Opin Biotechnol. 1998; 9(5):497-501. [DOI:10.1016/S0958-1669(98)80035-9]
Bourot S, Sire O, Trautwetter A, Touze T, Wu LF, Blanco C, et al. Glycine betaine-assisted protein folding in a lysA mutant of Escherichia coli. J Biol Chem. 2000; 275(2):1050-6. [DOI:10.1074/jbc.275.2.1050] [PMID]
Alibolandi M, Mirzahoseini H. Chemical assistance in refolding of bacterial inclusion bodies. Biochem Res Int. 2011; 2011:631607. [DOI:10.1155/2011/631607] [PMID] [PMCID]
Ke N, Berkmen M. Production of disulfide-bonded proteins in Escherichia coli. Curr Protoc Mol Biol. 2014; 108(16.1B):1-21. [DOI:10.1002/0471142727.mb1601bs108] [PMID]
Lee SH, Carpenter JF, Chang BS, Randolph TW, Kim YS. Effects of solutes on solubilization and refolding of proteins from inclusion bodies with high hydrostatic pressure. Protein Sci. 2006; 15(2):304-13. [DOI:10.1002/pro.27] [PMID] [PMCID]
Reddy KRC, Lilie H, Rudolph R, Lange C. L‐Arginine increases the solubility of unfolded species of hen egg white lysozyme. Protein Sci. 2005; 14(4):929-35. [DOI:10.1110/ps.041085005] [PMID] [PMCID]
Thomson CA, Olson M, Jackson LM, Schrader JW. A simplified method for the efficient refolding and purification of recombinant human GM-CSF. PLOS One. 2012; 7(11):e49891. [DOI:10.1371/journal.pone.0049891] [PMID] [PMCID]
متن کامل: (1477 مشاهده)
مقدمه
فاکتور رشد اندوتلیال عروقی Growth Factor Vascular Endothelial (VEGF) یک گلیکوپروتئین هومودایمر با وزن مولکولی 45-34 کیلو دالتون است که در سلولهای مختلف از جمله ماکروفاژ، پلاکت، کراتینوسایت، سلولهای مزانجیال کلیوی و نیز انواعی از سلولهای سرطانی تولید میشود. VEGF خاصیت آنژیوژنیک و میتوژنیک دارد. این پروتئین به عنوان عامل رشد و تمایز سلولهای استخوانی، هموستاز بعد از دوره نوزادی، بقای کندروسیتها، رگزایی و ترمیم بافتی عمل میکند. VEGF، پروتئین مؤثر در تمایز سلولهای پایه مزانشیمال به سلولهای اندوتلیال است که این ویژگی به عنوان نقطه عطف فعالیت این پروتئین در پدیده رگزایی منظور میشود [1].
ژن کدکننده VEGF، شامل 8 اگزون است که روی باند 12 بازوی کوتاه کروموزوم شماره 6 انسان، قرار دارند. از بیان این ژن، ایزومرهایVEGF-A, B, C, D, E, F و نیز عامل رشد جفتی (Placental growth factor (PLGF، تولید میشود [2]. زیرگونههای VEGF-A انسانی عبارت است از VEGF-A-121، 145، 165، 167، 183 و 189. فراوانترین و مهمترین این زیرگونهها، VEGF-A-165 است [3].
سلولهای پروکاریوتی بهویژه باکتریها به خاطر سهولت دستیابی، کشت ارزان و توان تولید انبوه پروتئینهای نوترکیب، از بهترین سیستمهای بیانی برای تولید پروتئینهای نوترکیب هستند. به رغم مزایای فراوان این سلولها برای تولید فراوردههای بیولوژیک نوترکیب، پروتئین ساختهشده به دلیل تغییر ساختار فضایی و خارجشدن از وضعیت طبیعی، عملکرد مناسب را نداشته و برای بازگرداندن ساختار طبیعی پروتئین نوترکیب و فعالکردن آن بایستی فرایند تاخوردگی مجدد، روی محصول تولیدشده اعمال شود. از معمولترین روشها برای اصلاح ساختار پروتئین نوترکیب، دیالیز شیمیایی این محصولات با استفاده از بافرهای اختصاصی است. انتخاب ترکیب این بافرها، با توجه به ویژگیهای ساختاری پروتئین نوترکیب مربوطه، مستلزم بهرهگیری از مواد افزودنی مختلف و صرف هزینه و زمان بسیار است. استفاده از نرمافزارهای شبیهساز، با فراهمکردن امکان واکنش مواد شیمیایی مختلف با پروتئین نوترکیب موردنظر در محیط مجازی، ساختار محصول نوترکیب را اصلاح میکند و با انتخاب بهترین مواد برای تاخوردگی مجدد محصول نوترکیب، از این مواد برای اصلاح ساختار پروتئین در شرایط آزمایشگاهی، با صرف هزینه کمتر و زمان کوتاهتر استفاده میشود [4].
با عنایت به این نکته که برای واردات VEGF نوترکیب، جهت اهداف پژوهشی، درمانی و غیره سالانه هزینههای فراوانی به کشور تحمیل میشود، تولید پروتئین نوترکیب مذکور، میتواند بخش کوچکی از مشکلات حوزه سلامت را برطرف کند.
در پژوهش حاضر، تولید نوترکیب این پروتئین به روش کلونینگ و سپس اصلاح ساختاری و بازگرداندن فعالیت این محصول با روشهای مبتنی بر نرمافزار و دیالیز شیمیایی، با تأکید بر استفاده هدفمند از افزودنیها در بافر دیالیز، اجرا شد. جهت ارزیابی کارایی فرایند تولید و بازآرایی پروتئین، عملکرد بیولوژیک آن در ایجاد تمایز سلولی، مورد بررسی قرار گرفت [5، 6].
مواد و روشها
مرحله تکثیر و انتقال ژن هدف
در این پژوهش تجربی آزمایشگاهی، ژن کدکننده VEGF-A165، با رمز شناسایی Acc: NM_001287044، از پایگاه NCBI استخراج شد. با اضافهکردن توالی مربوط به آنزیمهای محدودگر BamHI و XhoI در دو سر آن، ژن مذکور توسط شرکت بیوماتیک (Biomatic.Co. Canada) ساخته شد. فرایند ترانسفورمیشن (انتقال ژن هدف به سلول پروکاریوتیک تکثیری E. coli DH5α و سلولهای بیانی "E. coli BL21 "DE3 و Ssylp "Novagen, USA") به طریق شوک حرارتی و روش کوهن، انجام شد. برای فرایند القای بیان پروتئین از IPTG شرکت Thermo Scientific, Italy، استفاده شد [7-9].
مرحله استخراج پروتئین نوترکیب
با توجه به استفاده از پلاسمید pET 32a و الصاق دنباله شش اسید آمینه هیستیدین به محصول، جهت تخلیص پروتئین، از فناوری کروماتوگرافی تمایلی و کیت Ni-NTA (ستون رزین نیکل نیتروتری استیک اسید)، استفاده شد. برای تأیید حضور پروتئین نوترکیب مورد نظردر محصول نهایی، از روش SDS- PAGE استفاده شد. با توجه به اینکه بر اساس نتایج بهدستآمده از SDS-PAGE، میزان پروتئین تولیدشده در سلول DE3، به مراتب بیشتر از pLysS بود، در ادامه این طرح، کلیه مراحل مربوط به تولید پروتئین، روی سلول DE3، اجرا شد. غلظت پروتئین تخلیصشده، با روش اسپکتروفتومتری و با استفاده از فرمول شماره 1 بر حسب mg/ml محاسبه شد [10]:
فاکتور رشد اندوتلیال عروقی Growth Factor Vascular Endothelial (VEGF) یک گلیکوپروتئین هومودایمر با وزن مولکولی 45-34 کیلو دالتون است که در سلولهای مختلف از جمله ماکروفاژ، پلاکت، کراتینوسایت، سلولهای مزانجیال کلیوی و نیز انواعی از سلولهای سرطانی تولید میشود. VEGF خاصیت آنژیوژنیک و میتوژنیک دارد. این پروتئین به عنوان عامل رشد و تمایز سلولهای استخوانی، هموستاز بعد از دوره نوزادی، بقای کندروسیتها، رگزایی و ترمیم بافتی عمل میکند. VEGF، پروتئین مؤثر در تمایز سلولهای پایه مزانشیمال به سلولهای اندوتلیال است که این ویژگی به عنوان نقطه عطف فعالیت این پروتئین در پدیده رگزایی منظور میشود [1].
ژن کدکننده VEGF، شامل 8 اگزون است که روی باند 12 بازوی کوتاه کروموزوم شماره 6 انسان، قرار دارند. از بیان این ژن، ایزومرهایVEGF-A, B, C, D, E, F و نیز عامل رشد جفتی (Placental growth factor (PLGF، تولید میشود [2]. زیرگونههای VEGF-A انسانی عبارت است از VEGF-A-121، 145، 165، 167، 183 و 189. فراوانترین و مهمترین این زیرگونهها، VEGF-A-165 است [3].
سلولهای پروکاریوتی بهویژه باکتریها به خاطر سهولت دستیابی، کشت ارزان و توان تولید انبوه پروتئینهای نوترکیب، از بهترین سیستمهای بیانی برای تولید پروتئینهای نوترکیب هستند. به رغم مزایای فراوان این سلولها برای تولید فراوردههای بیولوژیک نوترکیب، پروتئین ساختهشده به دلیل تغییر ساختار فضایی و خارجشدن از وضعیت طبیعی، عملکرد مناسب را نداشته و برای بازگرداندن ساختار طبیعی پروتئین نوترکیب و فعالکردن آن بایستی فرایند تاخوردگی مجدد، روی محصول تولیدشده اعمال شود. از معمولترین روشها برای اصلاح ساختار پروتئین نوترکیب، دیالیز شیمیایی این محصولات با استفاده از بافرهای اختصاصی است. انتخاب ترکیب این بافرها، با توجه به ویژگیهای ساختاری پروتئین نوترکیب مربوطه، مستلزم بهرهگیری از مواد افزودنی مختلف و صرف هزینه و زمان بسیار است. استفاده از نرمافزارهای شبیهساز، با فراهمکردن امکان واکنش مواد شیمیایی مختلف با پروتئین نوترکیب موردنظر در محیط مجازی، ساختار محصول نوترکیب را اصلاح میکند و با انتخاب بهترین مواد برای تاخوردگی مجدد محصول نوترکیب، از این مواد برای اصلاح ساختار پروتئین در شرایط آزمایشگاهی، با صرف هزینه کمتر و زمان کوتاهتر استفاده میشود [4].
با عنایت به این نکته که برای واردات VEGF نوترکیب، جهت اهداف پژوهشی، درمانی و غیره سالانه هزینههای فراوانی به کشور تحمیل میشود، تولید پروتئین نوترکیب مذکور، میتواند بخش کوچکی از مشکلات حوزه سلامت را برطرف کند.
در پژوهش حاضر، تولید نوترکیب این پروتئین به روش کلونینگ و سپس اصلاح ساختاری و بازگرداندن فعالیت این محصول با روشهای مبتنی بر نرمافزار و دیالیز شیمیایی، با تأکید بر استفاده هدفمند از افزودنیها در بافر دیالیز، اجرا شد. جهت ارزیابی کارایی فرایند تولید و بازآرایی پروتئین، عملکرد بیولوژیک آن در ایجاد تمایز سلولی، مورد بررسی قرار گرفت [5، 6].
مواد و روشها
مرحله تکثیر و انتقال ژن هدف
در این پژوهش تجربی آزمایشگاهی، ژن کدکننده VEGF-A165، با رمز شناسایی Acc: NM_001287044، از پایگاه NCBI استخراج شد. با اضافهکردن توالی مربوط به آنزیمهای محدودگر BamHI و XhoI در دو سر آن، ژن مذکور توسط شرکت بیوماتیک (Biomatic.Co. Canada) ساخته شد. فرایند ترانسفورمیشن (انتقال ژن هدف به سلول پروکاریوتیک تکثیری E. coli DH5α و سلولهای بیانی "E. coli BL21 "DE3 و Ssylp "Novagen, USA") به طریق شوک حرارتی و روش کوهن، انجام شد. برای فرایند القای بیان پروتئین از IPTG شرکت Thermo Scientific, Italy، استفاده شد [7-9].
مرحله استخراج پروتئین نوترکیب
با توجه به استفاده از پلاسمید pET 32a و الصاق دنباله شش اسید آمینه هیستیدین به محصول، جهت تخلیص پروتئین، از فناوری کروماتوگرافی تمایلی و کیت Ni-NTA (ستون رزین نیکل نیتروتری استیک اسید)، استفاده شد. برای تأیید حضور پروتئین نوترکیب مورد نظردر محصول نهایی، از روش SDS- PAGE استفاده شد. با توجه به اینکه بر اساس نتایج بهدستآمده از SDS-PAGE، میزان پروتئین تولیدشده در سلول DE3، به مراتب بیشتر از pLysS بود، در ادامه این طرح، کلیه مراحل مربوط به تولید پروتئین، روی سلول DE3، اجرا شد. غلظت پروتئین تخلیصشده، با روش اسپکتروفتومتری و با استفاده از فرمول شماره 1 بر حسب mg/ml محاسبه شد [10]:
مرحله بازآرایی پروتئین
عطف به مطالب ذکرشده درقسمت مقدمه، در خصوص چالشهای فناوری تولید و بازآرایی پروتئین نوترکیب [11]، در اجرای این طرح، برای صرفهجویی در وقت و هزینهها، ابتدا با بهرهگیری از نرمافزارها، الگوی اصلاح ساختار پروتئین نوترکیب با حضورمکملهای شیمیایی مختلف در بافر دیالیز، شبیهسازی شد. ابتدا با ExPASy server، مقدار pH پروتئین هدف، تعیین شد. سپس با برنامه Aggre scan server، نواحی حساس اگریگیشن پروتئینی پیشبینی شد. با استفاده از بانک اطلاعات پروتئین، ساختار کریستالوگرافی VEGF، مشخص شد.
برای همسانسازی ساختار پروتئین از نرمافزار ویرایشگر Chimera Photo، استفاده شد. ساختار سهبعدی اسید امینههای موردنظر (سیستئین، پرولین، گلایسین و آرژنین)، از سایت PubChem، استخراج شد. با بهرهگیری از برنامه Hyperchem، انرژی همسانسازی پروتئین با مواد مکمل مختلف، مشخص شد [12]. جهت پیشبینی فرایند باراندازی اسیدهای امینه و مکملهای شیمیایی با نواحی حساس VEGF (داکینگ)، از نرمافزار AutoDock استفاده شد [13]. در انتها از نرمافزار LigPlot، جهت پیشگویی واکنشهای لیگاندهای هیدروژنیک و هیدروفوبیک VEGF-A و ارزیابی طول باندهای هیدروژنی پروتئین، استفاده شد [14]. برای دیالیز شیمیایی پروتئین، ابتدا بافر پایه PBS تهیه شد و سپس طبق جدول شماره 1 با انتخاب مکمل شیمیایی مختلف، 9 برنامه دیالیز روی محصول پروتئین تولیدشده، اجرا شد.
برای ارزیابی اثربخشی فرایند بازآرایی محصول بهدستآمده، از 9 برنامه دیالیز، جهت تیمار سلول پایه مزانشیمال و تمایز آن به سلول اندوتلیال (EC)، استفاده شد. ابتدا در یک پلیت کشت سلولی 24خانهای با گودههای تخت، در هر گوده، 5000 سلول MSc ریخته شد. در تراکم سلولی 50 درصد، طبق جدول شماره 2، تیمار سلولها به مدت 10 روز انجام شد. برای افزایش دقت آزمایش، در مورد گودههای تیمارشده با VEGF دستساز، به صورت دو گوده (دوپلیکیت) و در مورد کنترلها، تیمار در سه گوده (تریپلیکیت) انجام شد. از پروتئین تجارتی شرکت abcam (ab9571)، به عنوان کنترل مثبت استفاده شد.
برای ارزیابی میزان تمایز MSC به EC به روش فلوسایتومتری، شاخصهای اختصاصی (CD Markers) سلولهای مورد نظر، مورد ارزیابی قرار گرفت (جدول شماره 3).
تجزیه و تحلیل دادهها با آزمون تی مستقل و من ویتنی یو، انجام شد. میانگین و انحراف معیار دادهها، با نسخه 16 برنامه SPSS (IBMB corporation, NY, USA) محاسبه شد. حد معنیداری با P value کمتر از 0/05، مشخص شد.
یافتهها
به استناد دادههای پایگاه Expasi، میزان pH ایزو الکتریک (pI) VEGF-A، 2/9 تعیین شد و بر اساس آن میزان pH بافر پایه دیالیز، هشت در نظر گرفته شد. نتایج نرمافزار LigPlot، نشان داد که بین سیستئین و VEGF، باندهای هیدروژنی ضعیفتری نسبت به سایر اسیدهای امینه، ایجاد میشود. دادهها از سرور aggre scan، نواحی حساس تجمع پروتئین برای VEGF را مشخص کرد. این مکانها در تصویر شماره 1 با حروف درشت، نمایش داده شده است. بر اساس نتایج فلوسایتومتری، درصد سلولهای پایه و تمایزیافته بر اساس میزان شاخصهای مولکولی با روش فلو سایتومتری، مشخص شد (جدول شماره 4).
بحث
در ارزیابی عملکرد VEGF نوترکیب در ایجاد تمایز در سلولهای مزانشیمال به سلول اندوتلیال، دادههای این مطالعه نشان داد که شیب کاهش درصد شاخصهای سلولهای مزانشیمال، در سلولهای تیمارشده با پروتئین نوترکیب، نسبت به سلولهای تیمارشده با VEGF تجارتی، تندتر بود. این نتیحه مؤید تأثیر بیشتر VEGF ساختهشده نسبت به پروتئین تجارتی بود. این مطلب میتواند مؤید مناسببودن روش اصلاح ساختار پروتئین، در این مطالعه باشد؛ زیرا با بهرهگیری از روش شبیهسازی پروتئین در محیط مجازی، فرایند تاخوردگی مجدد پروتئین نوترکیب، هدفمند و انتخابی اجرا شد. نکته قابل بیان دیگر اینکه ممکن است پروتئین تجارتی خریداریشده و وارداتی، در پروسه نگهداری و حملونقل توسط شرکتهای داخلی که خارج از کنترل این مطالعه هستند، تا حدی فعالیتش را از دست داده باشد.
قدر مسلم، پروتئین تجارتی در ایجاد تمایز در سلول مزانشیمال به سمت اندوتلیال، عملکرد مثبت داشت، ولی توان پروتئین نوترکیب تولیدشده، بهتر از VEGF تجارتی بود. نتایج کلی اغلب مطالعات در این موضوع، با این مطالعه همخوانی داشت. در اغلب این مطالعات به نوعی از عملکرد بیولوژیک VEGF، استفاده شده بود و تأثیر این پروتئین در کنار عوامل دیگر به صورت اثربخشی تزایدی یا مهارکنندگی در مداخلات بالینی و آزمایشگاهی، ارزیابی شده بود. تفاوت عمده اغلب این مطالعات با مطالعه حاضر، این است که در این پژوهشها، از VEGF بافتی به جای نوع تجارتی، استفاده شده بود.
نقطه عطف مطالعه حاضر، بهینهسازی روش دیالیز پروتئین نوترکیب با بهرهگیری از الگوهای نرمافزاری و استفاده از بافرهای دیالیز حاوی مواد افزودنی متفاوت است. با توجه به اینکه قبل از اجرای فرایند دیالیز پروتئین به روش شیمیایی، از نرمافزارهای شبیهساز بازآرایی پروتئین استفاده شد، ضمن صرفهجویی در زمان، هزینه فرایند دیالیز پروتئین به حداقل رسید.
یافتههای حاصل از نرمافزارهای شبیهساز، با نتایج بخش تجربی آزمایشگاهی، همخوان بود و نشان داد پیشداوریهای نرمافزاری، مناسب بوده است. با توجه به ویژگیهای ساختاری VEGF، از جمله وجود باندهای دی سولفید متعدد، به عنوان یک پروتئین غنی از سیستئین [15]، در انتخاب روش تاخوردگی مجدد پروتئین، به این مشخصههای ساختاری پروتئین، توجه شد. در برنامههای شبیهسازی کامپیوتری، داشتن حداقل سطح انرژی پیوند بین پروتئین و مواد افزودنی همچنین وجود باند هیدروژنی طولانیتر و تعداد پیوندهای هیدروژنی کمتر با لیگاند مربوطه، به عنوان فاکتورهای انتخاب ماده شیمیایی مناسب، در نظر گرفته شد.
بعد از تلفیق دادههای برنامههای شبیهسازی کامپیوتری و اجرای روشهای آزمایشگاهی اصلاح ساختاری پروتئین، محصول نهایی، از نظر توان ایجاد تمایز روی سلول مزانشیمال به اندوتلیال، ارزیابی شد. بر اساس نتایج بهدستآمده، بهترین ترکیباتی که در بافر دیالیز برای اصلاح ساختار VEGF نوترکیب، استفاده شد، سیستئین و DDT بود. علاوه بر این دو ترکیب، نقش عواملی چون EDTA، آرژنین و تریتون X100، مورد تأیید قرار گرفت. با توجه به وجود باندهای دی سولفید متعدد در بخشهای مختلف ساختار VEGF، بهرهبرداری از اسید امینه سیستئین در ترکیب بافر دیالیز، کاملاً توجیه منطقی و بیوشیمیایی داشت. سیستئین میتواند در پروتئین نوترکیب با صرف انرژی پایین، باعث اصلاح ساختار پروتئین و تبدیل فرم غیرفعال آن به فرم فعال شود [16].
نقش دیگر سیستئین میتواند تسهیل فرایند در هم آمیختن باندهای دی سولفید باشد؛ زیرا این اسید امینه میتواند در پروتئین تغییر شکلیافته، به جای باندهای دی سولفید ضعیف با برقراری اتصالات قویتر وارد شده و با این مکانیسم ساختار پروتئین را تثبیت کند [17]. نتایج برنامه نرمافزار LigPlot، نیز نشان داد که این اسیدامینه به عنوان یک تثبیتکننده پروتئین، نسبت به سایر اسیدهای امینه، در مدل نرمافزاری، پیوند ضعیفتری با VEGF دارد. ارزیابیهای اعمال جهش خاص، نشان داد که باندهای دی سولفید متعدد، در هر زنجیره پلی پپتیدی VEGF، وجود دارد و رشتههای ثابت سیستئین در داخل لیگاندهای دیمر VEGF، از اختصاصیترین ویژگیهای ساختار VEGF هستند [17].
آرژنین، به عنوان یکی دیگر از مواد مکمل در بافر دیالیز، ممکن است باعث افزایش حلالیت پروتئین، از طریق گروه گوانیدین شود. به عبارت دیگر، گروههای آمین و کربوکسیل این اسید امینه، میتواند با پروتئین غیر فعالشده و آب، پیوند هیدروژنی ضعیف ایجاد کند، در حالی که گروه گوانیدین آرژنین با برقراری پیوندهای قویتر کاتیونی و الکترواستاتیک با اسیدهای امینه هیدروفوب سطحی پروتئین، واکنش میدهد. این ترکیب میتواند به عنوان یک مهارکننده اگریگیشن پروتئین نوترکیب عمل کند [18-20].
در مورد اثر آرژنین، نتایج بعضی مطالعات با مطالعه حاضر همخوانی داشت. این یافتهها نشان داد که آرژنین در بافر ریفولدینگ به عنوان یک ترکیب مفید در بازاصلاح پروتئین عمل میکند. از جمله در زمینه تولید چند پروتئین نوترکیب مثل بخش Fab آنتیبادی، آنزیم کازئین کیناز و زنجیره تکی ایمنوتوکسین [21، 22]، نقش مثبت مواد شیمیایی مختلف از جمله آرژنین در اصلاح ساختاری پروتئین نوترکیب ارزیابی و تأیید شده است. اما نتایج چندین مطالعه نشان داد که آرژنین ممکن است به عنوان یک دناتورهکننده پروتئین عمل کند. از جمله ژیا و همکاران نشان دادند که آرژنین ممکن است ساختار آمینو اسیلاز را منهدم کند. در مطالعه یانسی و همکاران، نتیجهگیری شده که آرژنین، میتواند ساختار و پایداری پروتئین را متزلزل کند و درنتیجه به عنوان یک عامل ضد ثبات پروتئین عمل کند [23، 24].
بر اساس نتایج حاصل از این مطالعه، مواد مکمل مفید در فرایند تاخوردگی مجدد VEGF، شامل سیستئین و DDT بود وEDTA نقش کمتری داشت. EDTA به عنوان یک ماده شیمیایی شلاتکننده و نیز مهارکننده آنزیم متالوپروتئاز، باعث کاهش واکنشهای اکسیداسیون شده و به این دلیل حلالیت پروتئین هدف را افزایش میدهد. در استفاده توأم EDTA، سیستئین و DDT، در یک برنامه دیالیز پروتئین، مشاهده شد که میزان CD44 به عنوان شاخص سلولهای بلاست و هماتوپوئتیک، کاهش مییابد. به عبارت دیگر استفاده ترکیبی این سه ماده در راستای تقویت تمایز سلول مزانشیمال به سمت سلول اندوتلیال است که مؤید افزایش طبیعیشدن ساختار پروتئین نوترکیب است.
DDT، همچنین به عنوان یک ترکیب ردوکس (اکسیداسیون و احیاکننده)، عمل میکند. به این صورت که باندهای دیسولفید معمول، از طریق واکنشهای تعویض تیول دی سولفید به جلو حرکت میکنند و تیولهای دیگر موجود در DDT، حلقه مربوطه را بسته و با ایجاد DDT اکسیدشده، از سمت پشت حلقه، باند دی سولفید احیاشده را ترک کرده و واکنش را متوقف میکند. این عملکرد DDT در شرایط قلیایی (همانگونه که در بافر مورد استفاده در این مطالعه وجود داشت)، بیشتر رخ میدهد [25]. در این مطالعه، عملکرد آرژنین، کمتر از سیستئین و DDT بود، اما به طور کلی، حضور آرژنین برای بازگرداندن ساختار و فعال کردن VEGF سننتتیک، مفید بود. نتایج این مطالعه نشان داد که پرولین، گلوکز و گلایسین، به عنوان عوامل بازدارنده در فرایند اصلاح ساختار VEGF نوترکیب عمل میکنند. دلیل این نقش منفی، ممکن است این باشد که گلایسین و گلوکز میتوانند از طریق فشردهکردن و کلاپسکردن ساختار پروتئین، باعث بدشکلی پروتئین شود [22].
گلوکز به عنوان یک مکمل با وزن مولکولی پایین، در مورد بعضی پروتئینها، میتواند ساختار پروتئین نوترکیب را از شکل انکلوژن بادی به حالت طبیعی برگرداند [26، 27]. پرولین نیز ممکن است از طریق اتصال به بخشهای بینابینی پیچخورده بعضی پروتئینهای نوترکیب، باعث مهار اگریگیشن پروتئین شود. همچنین این ترکیب ممکن است از طریق پوشاندن مکانهای هیدروفوب پروتئین هدف، مانع اگریگیشن شود. نکته مهمتر در خصوص نتایج متفاوت این مطالعه با چندین مطالعه مرتبط، ممکن است به دلیل ساختار ویژه VEGF، از جمله وجود باندهای دی سولفید متعدد و واکنشهای هیدروفوب درونمولکولی این پروتئین باشد.
مقدم و همکاران دریافتند که پروتئین غنی از سیستئین چیتیناز، میتواند توسط بافر دیالیز حاوی سوکروز، تریتون X100 DDT، گوانیدین کلراید و گلیسرول، اصلاح شود [28]. حضور باندهای دی سولفید متعدد در ساختار چیتیناز و VEGF، بهرهگیری از تریتون X100 و DDT را به عنوان ترکیبات مشترک در بافر دیالیز، با مطالعه حاضر، توجیه میکند. تریتون X100، یک سورفکتانت غیریونی است و به عنوان یک دترجنت لیزکننده عمل میکند. این ترکیب، اگریگیشن پروتئین را متوقف میکند و نتیجه حضور آن در بافر دیالیز، موجب افزایش میزان اصلاح ساختار پروتئین، میشود [29].
در راستای همخوانی مطالعات مرتبط با نتایج مطالعه حاضر و استفاده از این مواد، مطالعه لی و همکاران، قابل توجه است. در پژوهش مذکور، اینگونه نتیجهگیری شده که تریتون X100، با القای حلالیت پروتئینهای الیگومر، فرایند ریفولدینگ این گروههای پروتئینی را بیش از پروتئینهای منومر، حمایت و جهتدهی میکند [27]. این مطلب با ساختار VEGF، به عنوان یک پروتئین دایمر همخوانی دارد و نتایج مطالعه حاضر نشان داد که پروتئین نوترکیب تولیدشده، توسط تریتون X100، به ساختار طبیعی برمیگردد.
نتایج نشان داد که به کمک نرمافزارهای شبیهساز پروتئین و انتخاب مواد شیمیایی هدفمند، VEGF-A نوترکیب ساختهشده توانایی ایجاد تمایز در سلول مزانشیمال به اندوتلیال را دارد. یکی از کاستیها و کمبودهای این مطالعه، در دسترس نبودن پروتئینهای نوترکیب با ساختار متفاوت بود. در صورت فراهمشدن این شرایط، میتوان طیف وسیعی از پروتئینهای نوترکیب را با این روش دیالیز، به فرم طبیعی تبدیل کرد. با تحلیل دادههای وسیعتر در این مورد میتوان دستور کارهای عملیاتی برای اصلاح ساختار پروتئینهای نوترکیب با ساختار متنوع، پیشنهاد کرد.
نتیجهگیری
حضور مواد مکمل شامل آرژنین، سیستئین، DDT و NaCl در بافر دیالیز VEGF نوترکیب، باعث اصلاح ساختار این پروتئین و برگشت عملکرد آن از نظر ایجاد تمایز سلولهای پایه مزانشیمال به اندوتلیال میشود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
تمام آزمایشهای این پژوهش روی سلولهای زنده در شرایط استاندارد آزمایشگاه کشت سلول، با رعایت اصول ایمنی زیستی و بر اساس تأیید کمیته اخلاق در پژوهش دانشگاه علومپزشکی اراک، با شناسه ARAKMU. REC.1394.199 انجام شد.
حامی مالی
این مقاله حاصل از نتایج طرح تحقیقاتی مصوب شورای پژوهشی دانشگاه علومپزشکی اراک با شماره 2356 و تأمین مالی معاونت محترم تحقیقات و فناوری این دانشگاه، است.
مشارکت نویسندگان
طراحی و مدیریت علمی: حمید ابطحی؛ طراحی و اجرای فلوسایتومتری: دکتر قاسم مسیبی؛ اجرای فرآیند عملی تحقیق و نگارش مقاله: محسن خاکی .
تعارض منافع
نویسندگان این مقاله تصریح میکنندکه هیچگونه تضاد منافعی در پژوهش حاضر وجود ندارد.
تشکر و قدردانی
بدینوسیله از پشتیبانی مسئولین محترم پژوهشی دانشگاه علومپزشکی اراک، قدردانی میشود.
نقطه عطف مطالعه حاضر، بهینهسازی روش دیالیز پروتئین نوترکیب با بهرهگیری از الگوهای نرمافزاری و استفاده از بافرهای دیالیز حاوی مواد افزودنی متفاوت است. با توجه به اینکه قبل از اجرای فرایند دیالیز پروتئین به روش شیمیایی، از نرمافزارهای شبیهساز بازآرایی پروتئین استفاده شد، ضمن صرفهجویی در زمان، هزینه فرایند دیالیز پروتئین به حداقل رسید.
یافتههای حاصل از نرمافزارهای شبیهساز، با نتایج بخش تجربی آزمایشگاهی، همخوان بود و نشان داد پیشداوریهای نرمافزاری، مناسب بوده است. با توجه به ویژگیهای ساختاری VEGF، از جمله وجود باندهای دی سولفید متعدد، به عنوان یک پروتئین غنی از سیستئین [15]، در انتخاب روش تاخوردگی مجدد پروتئین، به این مشخصههای ساختاری پروتئین، توجه شد. در برنامههای شبیهسازی کامپیوتری، داشتن حداقل سطح انرژی پیوند بین پروتئین و مواد افزودنی همچنین وجود باند هیدروژنی طولانیتر و تعداد پیوندهای هیدروژنی کمتر با لیگاند مربوطه، به عنوان فاکتورهای انتخاب ماده شیمیایی مناسب، در نظر گرفته شد.
بعد از تلفیق دادههای برنامههای شبیهسازی کامپیوتری و اجرای روشهای آزمایشگاهی اصلاح ساختاری پروتئین، محصول نهایی، از نظر توان ایجاد تمایز روی سلول مزانشیمال به اندوتلیال، ارزیابی شد. بر اساس نتایج بهدستآمده، بهترین ترکیباتی که در بافر دیالیز برای اصلاح ساختار VEGF نوترکیب، استفاده شد، سیستئین و DDT بود. علاوه بر این دو ترکیب، نقش عواملی چون EDTA، آرژنین و تریتون X100، مورد تأیید قرار گرفت. با توجه به وجود باندهای دی سولفید متعدد در بخشهای مختلف ساختار VEGF، بهرهبرداری از اسید امینه سیستئین در ترکیب بافر دیالیز، کاملاً توجیه منطقی و بیوشیمیایی داشت. سیستئین میتواند در پروتئین نوترکیب با صرف انرژی پایین، باعث اصلاح ساختار پروتئین و تبدیل فرم غیرفعال آن به فرم فعال شود [16].
نقش دیگر سیستئین میتواند تسهیل فرایند در هم آمیختن باندهای دی سولفید باشد؛ زیرا این اسید امینه میتواند در پروتئین تغییر شکلیافته، به جای باندهای دی سولفید ضعیف با برقراری اتصالات قویتر وارد شده و با این مکانیسم ساختار پروتئین را تثبیت کند [17]. نتایج برنامه نرمافزار LigPlot، نیز نشان داد که این اسیدامینه به عنوان یک تثبیتکننده پروتئین، نسبت به سایر اسیدهای امینه، در مدل نرمافزاری، پیوند ضعیفتری با VEGF دارد. ارزیابیهای اعمال جهش خاص، نشان داد که باندهای دی سولفید متعدد، در هر زنجیره پلی پپتیدی VEGF، وجود دارد و رشتههای ثابت سیستئین در داخل لیگاندهای دیمر VEGF، از اختصاصیترین ویژگیهای ساختار VEGF هستند [17].
آرژنین، به عنوان یکی دیگر از مواد مکمل در بافر دیالیز، ممکن است باعث افزایش حلالیت پروتئین، از طریق گروه گوانیدین شود. به عبارت دیگر، گروههای آمین و کربوکسیل این اسید امینه، میتواند با پروتئین غیر فعالشده و آب، پیوند هیدروژنی ضعیف ایجاد کند، در حالی که گروه گوانیدین آرژنین با برقراری پیوندهای قویتر کاتیونی و الکترواستاتیک با اسیدهای امینه هیدروفوب سطحی پروتئین، واکنش میدهد. این ترکیب میتواند به عنوان یک مهارکننده اگریگیشن پروتئین نوترکیب عمل کند [18-20].
در مورد اثر آرژنین، نتایج بعضی مطالعات با مطالعه حاضر همخوانی داشت. این یافتهها نشان داد که آرژنین در بافر ریفولدینگ به عنوان یک ترکیب مفید در بازاصلاح پروتئین عمل میکند. از جمله در زمینه تولید چند پروتئین نوترکیب مثل بخش Fab آنتیبادی، آنزیم کازئین کیناز و زنجیره تکی ایمنوتوکسین [21، 22]، نقش مثبت مواد شیمیایی مختلف از جمله آرژنین در اصلاح ساختاری پروتئین نوترکیب ارزیابی و تأیید شده است. اما نتایج چندین مطالعه نشان داد که آرژنین ممکن است به عنوان یک دناتورهکننده پروتئین عمل کند. از جمله ژیا و همکاران نشان دادند که آرژنین ممکن است ساختار آمینو اسیلاز را منهدم کند. در مطالعه یانسی و همکاران، نتیجهگیری شده که آرژنین، میتواند ساختار و پایداری پروتئین را متزلزل کند و درنتیجه به عنوان یک عامل ضد ثبات پروتئین عمل کند [23، 24].
بر اساس نتایج حاصل از این مطالعه، مواد مکمل مفید در فرایند تاخوردگی مجدد VEGF، شامل سیستئین و DDT بود وEDTA نقش کمتری داشت. EDTA به عنوان یک ماده شیمیایی شلاتکننده و نیز مهارکننده آنزیم متالوپروتئاز، باعث کاهش واکنشهای اکسیداسیون شده و به این دلیل حلالیت پروتئین هدف را افزایش میدهد. در استفاده توأم EDTA، سیستئین و DDT، در یک برنامه دیالیز پروتئین، مشاهده شد که میزان CD44 به عنوان شاخص سلولهای بلاست و هماتوپوئتیک، کاهش مییابد. به عبارت دیگر استفاده ترکیبی این سه ماده در راستای تقویت تمایز سلول مزانشیمال به سمت سلول اندوتلیال است که مؤید افزایش طبیعیشدن ساختار پروتئین نوترکیب است.
DDT، همچنین به عنوان یک ترکیب ردوکس (اکسیداسیون و احیاکننده)، عمل میکند. به این صورت که باندهای دیسولفید معمول، از طریق واکنشهای تعویض تیول دی سولفید به جلو حرکت میکنند و تیولهای دیگر موجود در DDT، حلقه مربوطه را بسته و با ایجاد DDT اکسیدشده، از سمت پشت حلقه، باند دی سولفید احیاشده را ترک کرده و واکنش را متوقف میکند. این عملکرد DDT در شرایط قلیایی (همانگونه که در بافر مورد استفاده در این مطالعه وجود داشت)، بیشتر رخ میدهد [25]. در این مطالعه، عملکرد آرژنین، کمتر از سیستئین و DDT بود، اما به طور کلی، حضور آرژنین برای بازگرداندن ساختار و فعال کردن VEGF سننتتیک، مفید بود. نتایج این مطالعه نشان داد که پرولین، گلوکز و گلایسین، به عنوان عوامل بازدارنده در فرایند اصلاح ساختار VEGF نوترکیب عمل میکنند. دلیل این نقش منفی، ممکن است این باشد که گلایسین و گلوکز میتوانند از طریق فشردهکردن و کلاپسکردن ساختار پروتئین، باعث بدشکلی پروتئین شود [22].
گلوکز به عنوان یک مکمل با وزن مولکولی پایین، در مورد بعضی پروتئینها، میتواند ساختار پروتئین نوترکیب را از شکل انکلوژن بادی به حالت طبیعی برگرداند [26، 27]. پرولین نیز ممکن است از طریق اتصال به بخشهای بینابینی پیچخورده بعضی پروتئینهای نوترکیب، باعث مهار اگریگیشن پروتئین شود. همچنین این ترکیب ممکن است از طریق پوشاندن مکانهای هیدروفوب پروتئین هدف، مانع اگریگیشن شود. نکته مهمتر در خصوص نتایج متفاوت این مطالعه با چندین مطالعه مرتبط، ممکن است به دلیل ساختار ویژه VEGF، از جمله وجود باندهای دی سولفید متعدد و واکنشهای هیدروفوب درونمولکولی این پروتئین باشد.
مقدم و همکاران دریافتند که پروتئین غنی از سیستئین چیتیناز، میتواند توسط بافر دیالیز حاوی سوکروز، تریتون X100 DDT، گوانیدین کلراید و گلیسرول، اصلاح شود [28]. حضور باندهای دی سولفید متعدد در ساختار چیتیناز و VEGF، بهرهگیری از تریتون X100 و DDT را به عنوان ترکیبات مشترک در بافر دیالیز، با مطالعه حاضر، توجیه میکند. تریتون X100، یک سورفکتانت غیریونی است و به عنوان یک دترجنت لیزکننده عمل میکند. این ترکیب، اگریگیشن پروتئین را متوقف میکند و نتیجه حضور آن در بافر دیالیز، موجب افزایش میزان اصلاح ساختار پروتئین، میشود [29].
در راستای همخوانی مطالعات مرتبط با نتایج مطالعه حاضر و استفاده از این مواد، مطالعه لی و همکاران، قابل توجه است. در پژوهش مذکور، اینگونه نتیجهگیری شده که تریتون X100، با القای حلالیت پروتئینهای الیگومر، فرایند ریفولدینگ این گروههای پروتئینی را بیش از پروتئینهای منومر، حمایت و جهتدهی میکند [27]. این مطلب با ساختار VEGF، به عنوان یک پروتئین دایمر همخوانی دارد و نتایج مطالعه حاضر نشان داد که پروتئین نوترکیب تولیدشده، توسط تریتون X100، به ساختار طبیعی برمیگردد.
نتایج نشان داد که به کمک نرمافزارهای شبیهساز پروتئین و انتخاب مواد شیمیایی هدفمند، VEGF-A نوترکیب ساختهشده توانایی ایجاد تمایز در سلول مزانشیمال به اندوتلیال را دارد. یکی از کاستیها و کمبودهای این مطالعه، در دسترس نبودن پروتئینهای نوترکیب با ساختار متفاوت بود. در صورت فراهمشدن این شرایط، میتوان طیف وسیعی از پروتئینهای نوترکیب را با این روش دیالیز، به فرم طبیعی تبدیل کرد. با تحلیل دادههای وسیعتر در این مورد میتوان دستور کارهای عملیاتی برای اصلاح ساختار پروتئینهای نوترکیب با ساختار متنوع، پیشنهاد کرد.
نتیجهگیری
حضور مواد مکمل شامل آرژنین، سیستئین، DDT و NaCl در بافر دیالیز VEGF نوترکیب، باعث اصلاح ساختار این پروتئین و برگشت عملکرد آن از نظر ایجاد تمایز سلولهای پایه مزانشیمال به اندوتلیال میشود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
تمام آزمایشهای این پژوهش روی سلولهای زنده در شرایط استاندارد آزمایشگاه کشت سلول، با رعایت اصول ایمنی زیستی و بر اساس تأیید کمیته اخلاق در پژوهش دانشگاه علومپزشکی اراک، با شناسه ARAKMU. REC.1394.199 انجام شد.
حامی مالی
این مقاله حاصل از نتایج طرح تحقیقاتی مصوب شورای پژوهشی دانشگاه علومپزشکی اراک با شماره 2356 و تأمین مالی معاونت محترم تحقیقات و فناوری این دانشگاه، است.
مشارکت نویسندگان
طراحی و مدیریت علمی: حمید ابطحی؛ طراحی و اجرای فلوسایتومتری: دکتر قاسم مسیبی؛ اجرای فرآیند عملی تحقیق و نگارش مقاله: محسن خاکی .
تعارض منافع
نویسندگان این مقاله تصریح میکنندکه هیچگونه تضاد منافعی در پژوهش حاضر وجود ندارد.
تشکر و قدردانی
بدینوسیله از پشتیبانی مسئولین محترم پژوهشی دانشگاه علومپزشکی اراک، قدردانی میشود.
References
Yamagishi N, Teshima-Kondo S, Masuda K, Nishida K, Kuwano Y, Dang DT, et al. Chronic inhibition of tumor cell-derived VEGF enhances the malignant phenotype of colorectal cancer cells. BMC Cancer. 2013; 13(1):229. [DOI:10.1186/1471-2407-13-229] [PMID] [PMCID]
Lee SB, Park JS, Lee S, Park J, Yu S, Kim H, et al. Overproduction of recombinant human VEGF (vascular endothelial growth factor) in Chinese hamster ovary cells. J Microbiol Biotechnol. 2008; 18(1):183-7.
Vempati P, Popel AS, Mac Gabhann F. Extracellular regulation of VEGF: Isoforms, proteolysis, and vascular patterning. Cytokine Growth Factor Rev. 2014; 25(1):1-19. [DOI:10.1016/j.cytogfr.2013.11.002] [PMID] [PMCID]
Atilgan E, Hu J. Improving protein docking using sustainable genetic algorithms. Int J Compu Inoform Sys Ind Manag App. 2011; 3:248-55.
Khaki M, Salmanian AH, Abtahi H, Ganji A, Mosayebi G. Mesenchymal Stem Cells Differentiate to Endothelial Cells Using Recombinant Vascular Endothelial Growth Factor-A. Rep Biochem Mol Biol. 2018; 6(2):144-50. [PMID] [PMCID]
Kinashi H, Ito Y, Sun T, Katsuno T, Takei Y. Roles of the TGF-β-VEGF-C pathway in fibrosis-related lymphangiogenesis. Int J Mol Sci. 2018; 19(9):E2487. [DOI:10.3390/ijms19092487] [PMID] [PMCID]
Abbasian S, Soufian S, Nejad A, Abtahi H. Investigating the possibility of recombination the predicted antigenic fragment of Streptococcus pyogen hyaluronidase by bioinformatics softwares. Koomesh. 2015; 17(1):77-83.
Mirjamali NAS, Soufian S, Molaee N, Abbasian SS, Abtahi H. Cloning and expression of the enzymatic region of Streptococcal hyaluronidase. Iran J Basic Med Sci. 2014; 17(9):667-72. [PMID] [PMCID]
Didevara E, Abtahi H. Cloning and production of the monomer form of recombinant streptavidin and appraisal of its binding affinity to biotin. Koomesh. 2018; 20(1):115-21.
Hamzehloo Z, Mosayebi Gh, Khansarinejad B, Zolfaghari M, Abtahi H. Antigenicity Identification of a Novel Recombinant Multi-Epitope Antigen Based on FlaA and UreB Antigens of Helicobacter pylori. Jundishapur J Microbiol. 2019; 12(5):e66502.
Morozova VV, Vlassov VV, Tikunova NV. Applications of bacteriophages in the treatment of localized infections in humans. Front Microbiol. 2018; 9:1696. [DOI:10.3389/fmicb.2018.01696] [PMID] [PMCID]
Bystrov VS, Bdikin IK, Silibin M, Karpinsky D, Kopyl S, Paramonova EV, et al. Molecular modeling of the piezoelectric properties of ferroelectric composites containing Polyvinylidene Fluoride (PVDF) and either graphene or graphene oxide. J Mol Model. 2017; 23(4):128. [DOI:10.1007/s00894-017-3291-2] [PMID]
Mohamadyar-Toupkanlou F, Esfandiari M, Kashef-Saberi MS, Renani MK, Soleimani M. The structural bioinformatics analysis of biophenolic lignan-estrogen receptor interaction. Curr Cancer Drug Targets. 2017. [DOI:10.2174/1568009617666170623121446] [PMID]
Wallace AC, Laskowski RA, Thornton JM. LIGPLOT: A program to generate schematic diagrams of protein-ligand interactions. Protein Eng Des Sel. 1995; 8(2):127-34. [DOI:10.1093/protein/8.2.127] [PMID]
Claffey KP, Senger DR, Spiegelman BM. Structural requirements for dimerization, glycosylation, secretion, and biological function of VPF/VEGF. Biochim Biophys Acta. 1995; 1246(1):1-9. [DOI:10.1016/0167-4838(94)00144-6]
Walker KW, Lyles MM, Gilbert HF. Catalysis of oxidative protein folding by mutants of protein disulfide isomerase with a single active-site cysteine. Biochem. 1996; 35(6):1972-80. [DOI:10.1021/bi952157n] [PMID]
Cothran A, St John RJ, Schmelzer CH, Pizarro SA. High-pressure refolding of human Vascular Endothelial Growth Factor (VEGF) recombinantly expressed in bacterial inclusion bodies: Refolding optimization, and feasibility assessment. Biotechnol Prog. 2011; 27(5):1273-81. [DOI:10.1002/btpr.642] [PMID]
Buchner J, Rudolph R. Renaturation, purification and characterization of recombinant Fab-fragments produced in Escherichia coli. Biotechnology (N Y). 1991; 9(2):157-62. [DOI:10.1038/nbt0291-157] [PMID]
Inoue N, Takai E, Arakawa T, Shiraki K. Arginine and lysine reduce the high viscosity of serum albumin solutions for pharmaceutical injection. J Biosci Bioeng. 2014; 117(5):539-43. [DOI:10.1016/j.jbiosc.2013.10.016] [PMID]
Arakawa T, Kita Y. Multi-faceted arginine: Mechanism of the effects of arginine on protein. Curr Protein Pept Sci. 2014; 15(6):608-20. [DOI:10.2174/138920371506140818113015] [PMID]
Arora D, Khanna N. Method for increasing the yield of properly folded recombinant human gamma interferon from inclusion bodies. J Biotechnol. 1996; 52(2):127-33. [DOI:10.1016/S0168-1656(96)01636-7]
Xia Y, Park YD, Mu H, Zhou HM, Wang XY, Meng FG. The protective effects of osmolytes on arginine kinase unfolding and aggregation. Int J Biol Macromol. 2007; 40(5):437-43. [DOI:10.1016/j.ijbiomac.2006.10.004] [PMID]
Lilie H, Schwarz E, Rudolph R. Advances in refolding of proteins produced in E. coli. Curr Opin Biotechnol. 1998; 9(5):497-501. [DOI:10.1016/S0958-1669(98)80035-9]
Bourot S, Sire O, Trautwetter A, Touze T, Wu LF, Blanco C, et al. Glycine betaine-assisted protein folding in a lysA mutant of Escherichia coli. J Biol Chem. 2000; 275(2):1050-6. [DOI:10.1074/jbc.275.2.1050] [PMID]
Alibolandi M, Mirzahoseini H. Chemical assistance in refolding of bacterial inclusion bodies. Biochem Res Int. 2011; 2011:631607. [DOI:10.1155/2011/631607] [PMID] [PMCID]
Ke N, Berkmen M. Production of disulfide-bonded proteins in Escherichia coli. Curr Protoc Mol Biol. 2014; 108(16.1B):1-21. [DOI:10.1002/0471142727.mb1601bs108] [PMID]
Lee SH, Carpenter JF, Chang BS, Randolph TW, Kim YS. Effects of solutes on solubilization and refolding of proteins from inclusion bodies with high hydrostatic pressure. Protein Sci. 2006; 15(2):304-13. [DOI:10.1002/pro.27] [PMID] [PMCID]
Reddy KRC, Lilie H, Rudolph R, Lange C. L‐Arginine increases the solubility of unfolded species of hen egg white lysozyme. Protein Sci. 2005; 14(4):929-35. [DOI:10.1110/ps.041085005] [PMID] [PMCID]
Thomson CA, Olson M, Jackson LM, Schrader JW. A simplified method for the efficient refolding and purification of recombinant human GM-CSF. PLOS One. 2012; 7(11):e49891. [DOI:10.1371/journal.pone.0049891] [PMID] [PMCID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |